♦OBJECTIF : Mener une méta-analyse d'études cas-témoins visant à déterminer si l'utilisation préalable de contraceptifs oraux (CO) est associée au risque de cancer du sein chez la femme préménopausée.
MÉTHODES : Nous avons examiné les banques de données Medline et PubMed et des revues bibliographiques afin d'y identifier des études cas-témoins concernant les contraceptifs oraux et le cancer du sein chez la femme préménopausée publiées durant ou après 1980. Parmi les termes de recherche utilisés figurent néoplasmes du sein, contraceptifs oraux, agents contraceptifs, et études cas-témoins. Nous avons pris en compte des études disponibles dans toutes les langues. Nous avons identifié 34 études satisfaisant les critères d'inclusion. Deux chercheurs ont extrait des données à partir d'articles de recherche originaux ou de données supplémentaires fournies par les auteurs de ces études. Pour évaluer le lien entre l'utilisation de contraceptifs oraux et le cancer, nous avons utilisé la méthode de DerSimonian-Laird pour calculer les rapports de cotes combinés (RC) et les intervalles de confiance (IC), ainsi que le test de Mantel-Haenszel.
RÉSULTATS : L'utilisation de contraceptifs oraux est associée à une augmentation du risque de cancer du sein chez la femme postménopausée en général, (RC, 1,19; 95% IC, 1,09-1,29) et pour différents schémas d'utilisation des CO. Dans les études fournissant des données sur les femmes nullipares et unipares/multipares séparément, l'utilisation de CO est associée au risque de cancer du sein aussi bien chez les femmes unipares/multipares (RC, 1,29; 95% IC, 1,20-1,40) que chez les femmes nullipares (RC, 1,29 ; 95% IC, 0,92-1,67). L'utilisation plus prolongée des CO chez les femmes nullipares ne modifie pas significativement le risque (RC, 1,29, 95% IC, 0,85-1,96). Chez les femmes unipares/multipares, l'association est plus forte lorsque les contraceptifs oraux ont été utilisés avant la première grossesse menée à terme (PGMT) (RC, 1,44, 95% IC, 1,28-1,62) que lorsqu'ils ont été pris après la PGMT (RC, 1,15, 95% IC, 1,06-1,26). Le lien le plus fort entre l'utilisation de CO et le risque de cancer du sein est observé chez les femmes unipares/multipares qui avaient utilisé des CO pendant 4 ans ou plus avant la PGMT (RC, 1,52; 95% IC, 1,26-1,82).
CONCLUSION : L'utilisation de CO est associée à un risque majeur de cancer du sein chez la femme préménopausée, notamment s'ils sont utilisés avant la PGMT.
Mayo Clin Proc. 2006 ; 81(10) : 1290-1302
IC = intervalle de confiance ; PGMT = première grossesse menée à terme ; CO = contraceptifs oraux ; RC = rapport de cotes, ou ratio d'incidence approché (odds ratio)
♦Le cancer du sein est, au niveau mondial, la forme prépondérante de cancer chez les femmes et constitue la cause, la plus fréquente de mortalité par cancer chez les femmes nord-américaines âgées de 20 à 59 ans.1 Chaque année aux États-Unis, le cancer du sein frappe environ 211 000 femmes, dont plus de 47 000 (20%) avant leur 50 ans.2 Deux femmes nord-américaines sur 15 environ développeront un cancer du sein au cours de leur vie et presque 40 000 d'entre elles en décèderont chaque année.2 Durant les 4 dernières décennies, le taux de cancer du sein s'est progressivement élevé dans le monde, notamment et plus vite dans les pays développés et chez les femmes plus jeunes. Par exemple, de 1973 à 1999, le taux de cancer du sein aux États-Unis a augmenté de 9,8% chez les femmes blanches de moins de 50 ans (de 39,8 à 43,7 pour 100 000 personnes) et de 26,4% chez les femmes afro-américaines de moins de 50 ans (de 34,8 à 44,0 pour 100 000 personnes).3
La communauté scientifique médicale reconnaît depuis longtemps l'existence de facteurs de risque de cancer du sein tels que les antécédents familiaux positifs de cette maladie, la ménarche précoce, la ménopause tardive, la nulliparité et l'absence d'allaitement maternel4,7 ; cependant, il existe des divergences quant au potentiel carcinogénique des hormones féminines. Le Women's Health Initiative Clinical Trial a rapporté qu'une exposition prolongée aux oestrogènes et aux progestines exogènes dans la thérapie hormonale majore le risque de cancer du sein chez la femme.8 De surcroît, l'Organisation Mondiale de la Santé a récemment classé la thérapie de substitution hormonale aussi bien que les contraceptifs oraux (CO) comme des carcinogènes du groupe 1.9
Dans la littérature médicale, le lien entre les CO et le risque subséquent de cancer du sein a varié au cours du temps. Seule 1 étude sur 15 menées avant 1980 en montrait une corrélation positive.10 Cependant, des études plus récentes ont fait état d'une augmentation du risque parmi les utilisatrices de CO, notamment parmi celles les ayant utilisées avant la première grossesse menée à terme (PGMT).10-15 La différence entre les anciennes et les nouvelles constatations pourrait obéir au changement de mode d'utilisation des CO : les femmes qui en prenaient depuis la fin des années 1970 et tout au long des années 1990 étaient plus enclines à les utiliser avant la PGMT et pendant des périodes plus prolongées que celles des années 60 et du début des années 70.11 Les femmes exposées aux carcinogènes avant la PGMT peuvent risquer davantage de développer un cancer du sein car le tissu glandulaire du sein n'a pas encore subi la différenciation plus avancée que déclenche à la grossesse.16 La différenciation de la glande mammaire durant la grossesse inhibe l'initiation de la carcinogénèse16 ce qui expliquerait la protection naturelle que la grossesse confère à cet égard.17,18
Nous avons entrepris une méta-analyse d'études cas-témoins menées depuis 1980 inclus, afin d'éclaircir le lien possible entre l'utilisation de CO et le risque de cancer du sein chez les femmes préménopausées ou les femmes de moins de 50 ans. Pour ce qui est des analyses ici présentées, nous avons considéré que la plupart des femmes âgées de moins de 50 ans étaient préménopausées. Nous avons limité notre analyse à des études dans lesquelles la plupart des femmes avaient développé un cancer du sein durant ou après 1980, en vue de disposer d'une période de latence suffisante entre l'utilisation de CO et le diagnostic de cancer du sein. Nous avons également limité notre analyse aux femmes préménopausées car la plupart des femmes postménopausées incluses dans les études des années 80 et 90 n'avaient pas subi d'exposition prolongée aux CO avant la PGMT ; par conséquent, le rapport entre l'utilisation de CO, la grossesse et la maladie chez la femme postménopausée était difficile à évaluer.
MÉTHODES
RECHERCHE BIBLIOGRAPHIQUE, SOURCES DE DONNÉES ET SÉLECTION DES ÉTUDES
Nous avons examiné les banques de données Medline et PubMed en vue d'identifier des études cas-témoins sur le cancer du sein et l'utilisation de CO, publiées durant ou après 1980. Parmi les termes de recherche utilisés figurent néoplasmes du sein, contraceptifs oraux, agents contraceptifs, et études cas-témoins. Nous avons trouvé des études supplémentaires en examinant les bibliographies des études identifiées et de méta-analyses antérieures.10-15
Nos analyses comportent uniquement des études sur des cas et des témoins femmes de moins de 50 ans ou préménopausées ayant développé, dans la plupart des cas, un cancer du sein durant ou après 1980. Au total, 60 études potentiellement éligibles ont été identifiées. Vingt-six études ont été exclues pour des raisons diverses : 8 études sont fondées sur des données datant principalement d'avant 1980,19-25 2 études (qui ont été identifiées dans l'étude Oxford11) n'avaient jamais été publiées, 1 étude avait envisagé exclusivement l'utilisation des hormones à des fins non contraceptives,26 Une étude avait considéré des femmes âgées de 50 ans ou plus27 et 2 études28,29 avaient été intégrées dans une autre plus récente incluse dans le présent travail.30 Une étude a été exclue car la plupart des femmes avaient utilisé des CO pendant 6 mois ou moins avant la PGMT31; 11 études ont été exclues en raison de l'absence de données spécifiques aux femmes préménopausées ou aux femmes âgées de moins de 50 ans.32-42 Ce qui a donné un total de 34 études éligibles30, 43-75 Quatre études66,67,72,75 ont présenté leurs données en deux groupes d'âge séparées. Wingo et al,72 Shapiro et al,67 et Rosenberg et al75 ont présenté leurs données par catégories d'âge, de moins de 35 ans et de 35 à 44 ans. Rosenberg et al66 ont présenté des données par catégories d'âge de moins de 40 ans et de 40 à 49 ans. Cela veut dire que, pour ces études, les femmes ont été classées selon l'âge auquel la maladie a été diagnostiquée (cas) ou l'âge auquel elles ont été intégrées dans l'étude (témoins). L'une des études a choisi des témoins provenant soit de la population hospitalière, soit de la population générale en fonction des lieux ; nous l'avons traitée comme deux études indépendantes68. De ce fait, il y a eu un total de 39 études potentiellement indépendantes pour l'analyse, listées dans la Table 1.30,43-74 Parmi ces 39 études, 2 études54,74 ne fournissent pas de données sur les antécédents d'utilisation ou de non utilisation préalable de CO par toutes les femmes mais elles fournissent des données relatives à d'autres catégories d'analyse par sous-groupes (utilisation ou non utilisation préalable de CO par les femmes unipares/ multipares, utilisation par les femmes unipares/multipares avant ou après la PGMT), donc ces études sont incluses dans certaines des analyses présentées ici.
Nous avons essayé de contacter les auteurs des études lorsque les données relatives à l'histoire d'utilisation de CO avant la PGMT étaient insuffisantes. Plusieurs auteurs ont fourni ces données.48,55,61,64,65,71,73,74 Nous n'avons pas analysé le sous-groupe de femmes prenant des CO avant la PGMT dans les études où la plupart des femmes avaient utilisé des CO pour une période inférieure à 6 mois avant le PGMT.31,44 Nous avons évité la duplication des données présentes dans des rapports de publication multiples ; pour ces cas, nous avons retenu la version la plus récente ou la plus complète de l'étude. Sont concernées ici 3 études nord-américaines4,59,72,75-80, une étude suédoise57,81 et une étude italienne.28-30
EXTRACTION DES DONNÉES
L'ensemble des données ont été extraites par deux personnes de façon indépendante (C.K. et un assistant de recherche) et saisies sur une feuille de calcul Excel (Microsoft Inc., Redmond, Wash). Le processus d'extraction a comporté des descriptions sur la conception de l'étude, ainsi que les mesures d'exposition et des résultats en détail. L'information descriptive comprenait l'auteur, l'année et la langue de publication, l'emplacement de l'étude, la période de recrutement, le type d'étude (population hospitalière ou générale), les taux de participation et le type d'interview. Les mesures d'exposition incluaient les antécédents d'utilisation de CO, les antécédents d'utilisation de CO par des femmes unipares/multipares, les antécédents d'utilisation avant et après la PGMT par des femmes unipares/multipares, l'utilisation de CO pendant 4 ans ou plus avant la PGMT par les femmes unipares/multipares, les antécédents d'utilisation de CO par les femmes nullipares et l'utilisation de CO pendant 4 ans ou plus par des femmes nullipares. Toutes les données prélevées ont été révisées par une tierce personne (F.M.) et les désaccords ont été collectivement résolus.
ANALYSE STATISTIQUE
Cette méta-analyse s'est servie du modèle d'effets aléatoires de DerSimonian-Laird82 pour calculer les rapports de cotes groupés (RC), les intervalles de confiance de 95% (IC) et les valeurs P pour l'hypothèse nulle de non association entre l'utilisation de CO et le cancer. Les RC individuels et leurs variances ont été calculés à partir du nombre brut des cas et des témoins publié pour chaque étude. L'homogénéité des RC a été estimée de manière standard, en utilisant la statistique Q (voir, par exemple, DerSimonian et Laird82).
Dans le cas des analyses relatives au sous-groupe de femmes unipares/multipares qui utilisaient des CO avant la PGMT, la plupart des études ont défini comme « non utilisatrices » les femmes n'ayant jamais utilisé de CO. Cependant, une étude58 a défini comme « non utilisatrices » les femmes qui n'avaient pas utilisé de CO avant la PGMT (mais qui en auraient éventuellement utilisé à posteriori). Deux études43,75 ont défini comme « non utilisatrices » les femmes qui avaient utilisé des CO pendant moins de 6 ou 12 mois, respectivement. Nous avons conduit nos analyses en incluant puis en excluant ces 3 études, sans remarquer de différence dans les résultats.
|
TABLE
1. Études d'utilisation de contraceptifs oraux et de risque de cancer
du sein chez les femmes
*
Type d'étude : G = population générale; H = population
hospitalière ;
OMS = Organisation Mondiale de la Santé |
RÉSULTATS
Parmi les 34 études retenues pour notre analyse, 14 sont basées sur une population hospitalière, 19 sur une population générale et 1 est une combinaison de témoins de populations hospitalière et générale. Les études proviennent de plusieurs pays : Australie (1),55 Brésil (2),48,68 Canada (1),66 Chine(1),74 Costa Rica (1),50 Danemark (1),47 Angleterre (2),45,56 France (2),46,49 Italie (3),30,54,69 Nouvelle-Zélande (1),63 Singapour (1),51 Slovénie (1),64 Afrique du Sud (1),67 Suède (2),57,61 Taiwan (1),44 Pays-Bas (1),65 et États-Unis (11)42,43,52,53,58,59,62,71-73,75. Une étude analyse des données multinationales.60
Dans l'ensemble, l'utilisation de CO est associée à une augmentation du risque de cancer du sein (Figure 1), avec un RC combiné de 1,19 (95% IC, 1,09-1,29). Parmi les 39 études indiquées dans la Table 1, 2 études54,74 ne contiennent pas de données sur les antécédents d'utilisation de CO, si bien qu'elles n'ont pas intégré l'analyse de la Figure 1. Parmi les 37 études restantes, un total de 29 ont des RC supérieurs à 1 et 8 ont des RC inférieurs à 1. 9 études rapportent un P < 0,05 (allant de 5 x 10-8 à 0,031) pour l'hypothèse nulle de non association entre l'utilisation de CO et le cancer ; une seule de ces 9 études donne un RC inférieur à 1. Dans l'analyse combinée, la valeur P de non association entre l'utilisation de CO et le cancer est de 9,5 10-5. Nous constatons que la valeur P pour l'homogénéité entre les études est de 2,0 10–6; il existe ainsi une claire évidence des différences entre les études. Bien que l'hétérogénéité soit clairement présente, la source ne peut en être ni tracée ni inférée à partir des rapports individuels. Cette hétérogénéité pourrait bien dériver de la variabilité du pool génétique des populations de chaque étude particulière, et des différents facteurs culturels et environnementaux.
| |
Cas/Témoins |
|
|
|
|
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | 1,19 (1,09-1,29) | 9,5 x 10–5 | 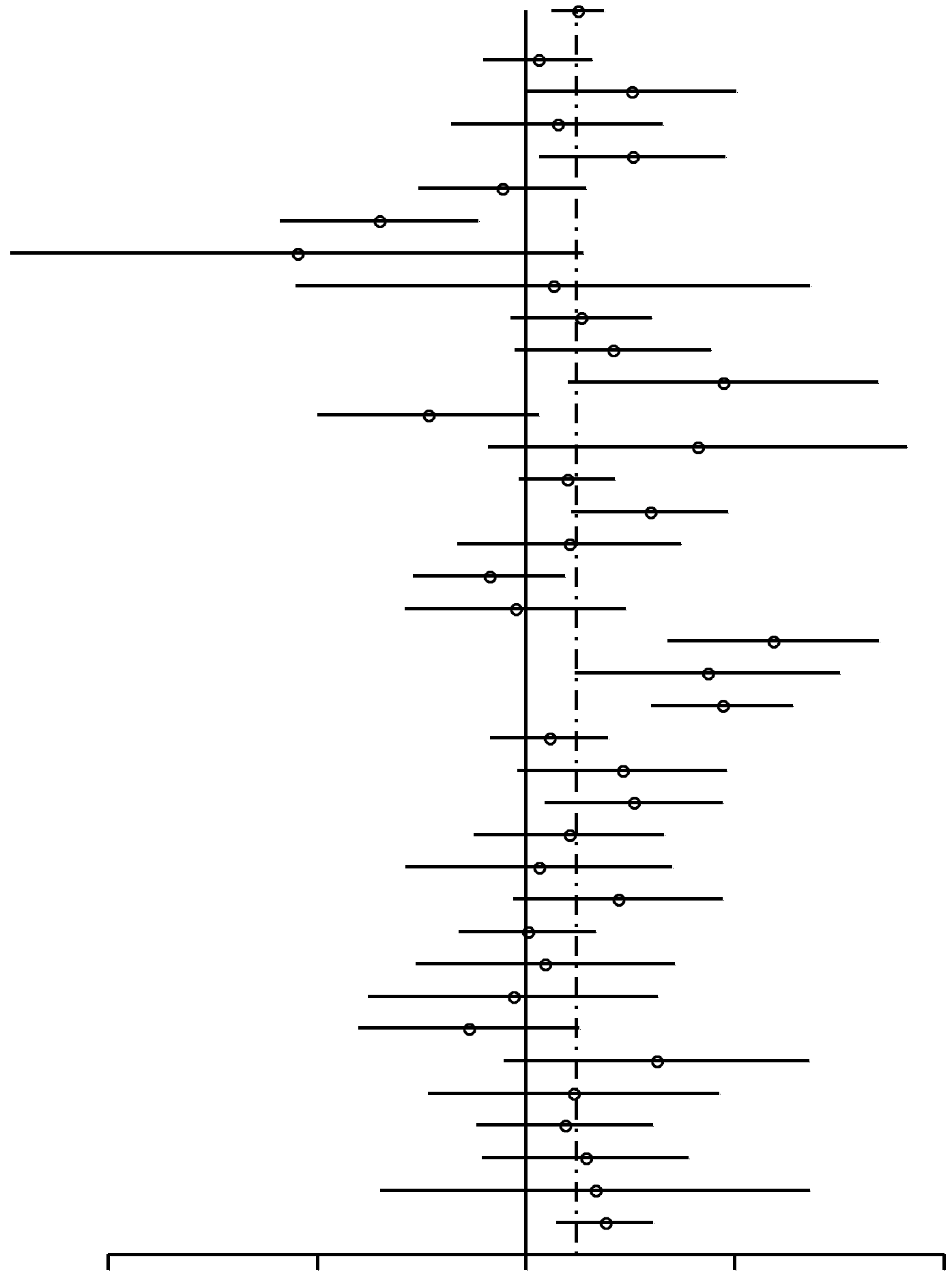 |
||
| Wingo,72 1993* | 117/976 | 328/298 | 1,04 (0,87-1,24) | 0,70 | |
| Wingo,72 1993† | 432/556 | 57/104 | 1,42 (1-2) | 0,058 | |
| White,73 1994 | 689/879 | 58/82 | 1,11 (0,78-1,57) | 0,63 | |
| Weinstein,71 1991 | 175/145 | 151/178 | 1,42 (1,04-1,94) | 0,031 | |
| Ursin,70 1999 | 618/626 | 124/116 | 0,92 (0,7-1,22) | 0,62 | |
| Traina,69 1996 | 103/138 | 197/162 | 0,61 (0,44-0,85) | 0,0047 | |
| Tessaro,68 2001‡ | 40/139 | 8/13 | 0,47 (0,18-1,21) | 0,19 | |
| Tessaro,68 2001§ | 44/146 | 8/29 | 1,09 (0,47-2,56) | 0,99 | |
| Tavani,30 1999 | 221/227 | 358/441 | 1,2 (0,95-1,51) | 0,14 | |
| Shapiro,67 2000* | 91/274 | 98/393 | 1,33 (0,96-1,84) | 0,099 | |
| Shapiro,67 2000† | 36/140 | 34/254 | 1,92 (1,15-3,21) | 0,017 | |
| Rosenberg,66 1992* | 98/225 | 79/131 | 0,72 (0,5-1,04) | 0,099 | |
| Rosenberg,66 1992† | 66/118 | 13/41 | 1,76 (0,88-3,53) | 0,15 | |
| Rosenberg,75 1996* | 455/606 | 617/940 | 1,14 (0,98-1,34) | 0,10 | |
| Rosenberg,75 1996† | 184/421 | 134/462 | 1,51 (1,16-1,95) | 0,0023 | |
| Rookus,65 1994 | 613/605 | 58/66 | 1,15 (0,8-1,67) | 0,51 | |
| Primic-Zakelj,64 1995 | 250/249 | 251/221 | 0,88 (0,69-1,14) | 0,37 | |
| Paul,63 1990 | 345/1081 | 43/130 | 0,96 (0,67-1,39) | 0,92 | |
| Palmer,62 1995 | 119/222 | 65/275 | 2,27 (1,6-3,22) | 5,4 x 10–6 | |
| Olsson,61 1989 | 143/329 | 31/130 | 1,82 (1,18-2,82) | 0,0092 | |
| Étude OMS,60 1990 | 160/1613 | 141/2722 | 1,91 (1,51-2,42) | 5,2 x 10–8 | |
| Newcomb,59 1996 | 862/1555 | 188/366 | 1,08 (0,89-1,31) | 0,47 | |
| Moorman,58 2001 | 428/328 | 75/79 | 1,37 (0,97-1,94) | 0,087 | |
| Meirik,57 1986 | 326/371 | 96/156 | 1,43 (1,06-1,92) | 0,021 | |
| McPherson,56 1987 | 240/229 | 111/122 | 1,15 (0,84-1,58) | 0,42 | |
| McCredie,55 1998 | 418/366 | 46/42 | 1,04 (0,67-1,62) | 0,94 | |
| Marcus,53 1999 | 428/328 | 76/79 | 1,36 (0,96-1,92) | 0,10 | |
| Marchbanks,52 2002 | 1264/1305 | 165/171 | 1,0 (0,8-1,26) | 0,98 | |
| Lee,50 1987 | 50/302 | 47/302 | 1,06 (0,69-1,63) | 0,86 | |
| Lee,51 1992 | 41/80 | 68/127 | 0,96 (0,59-1,54) | 0,95 | |
| Le,49 1985 | 161/217 | 79/88 | 0,83 (0,57-1,19) | 0,35 | |
| Gomes,48 1995 | 35/60 | 64/169 | 1,54 (0,93-2,56) | 0,12 | |
| Ewertz,47 1992 | 165/167 | 38/45 | 1,17 (0,72-1,9) | 0,61 | |
| Clavel,46 1991 | 204/204 | 154/175 | 1,14 (0,85-1,52) | 0,43 | |
| UK National45 1989 | 688/675 | 67/80 | 1,22 (0,86-1,71) | 0,30 | |
| Chie,44 1998 | 13/26 | 84/211 | 1,26 (0,62-2,56) | 0,66 | |
| Brinton,43 1995 | 1259/1074 | 389/431 | 1,3 (1,11-1,52) | 0,0015 | |
| 0,250,51,02,04,0 | |||||
|
FIGURE 1. Résumé des estimations du risque de cancer du sein chez les femmes préménopausées et les femmes de moins de 50 ans associé aux antécédents d'utilisation de contraceptifs oraux (CO) Parmi les 39 études éligibles énumérées dans la Table 1, 37 ont fourni des données sur les antécédents d‘utilisation ou de non utilisation préalable de CO. Inclut des études cas-témoins auprès de femmes préménopausées autant unipares/multipares que nullipares (ou de moins de 50 ans) ayant utilisé des CO vis-à-vis de femmes qui n'en ont jamais utilisé. Pour chaque étude, la plupart des patientes ont développé un cancer du sein après 1980. *Sous-ensemble de femmes de 35 ans ou plus (Rosenberg75, Wingo72) ou de 40 ans ou plus (Rosenberg66). † Sous-ensemble de femmes de moins de 35 ans (Rosenberg75, Wingo72) ou de moins de 40 ans (Rosenberg66). ‡Témoins de voisinage. §Témoins d'hôpital. IC = intervalle de confiance; RC = rapport de cotes; OMS = Organisation Mondiale de la Santé. Pour une question de place, seul le premier des auteurs est cité. |
|||||
Comme on peut l'observer dans la Figure 2, les RC pour les femmes nullipares ayant occasionnellement utilisé des CO (RC, 1,24; 95% IC, 0,92-1,67) sont similaires à ceux des femmes nullipares ayant utilisé des CO pour une période de 4 ans ou plus (RC, 1,29; 95% IC, 0,85-1,96). Parmi les femmes unipares/multipares (Figures 3 et 4), l'association entre l'utilisation de CO et le risque de cancer du sein chez les utilisatrices éventuelles est de 1,29 (95% IC, 1,20-1,40). Le risque de cancer du sein associé à l'utilisation de CO avant la PGMT (RC, 1,44; 95% IC, 1,28-1,62; 99% IC, 1,24-1,68) est plus élevé que le risque lié à l'utilisation de CO après la PGMT (RC, 1,15; 95% IC, 1,06-1,26). L'association la plus élevée entre l'utilisation de CO et le risque de cancer du sein s'affiche chez les femmes unipares/multipares ayant utilisé des CO pendant 4 ans ou plus avant la PGMT (RC, 1,52; 95% IC, 1,26-1,82 ; 99% IC, 1,19-1,93).
| |
Cas/Témoins |
|
|
|
|
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | |
|
1,24 (0,92-1,67) | 0,17 | 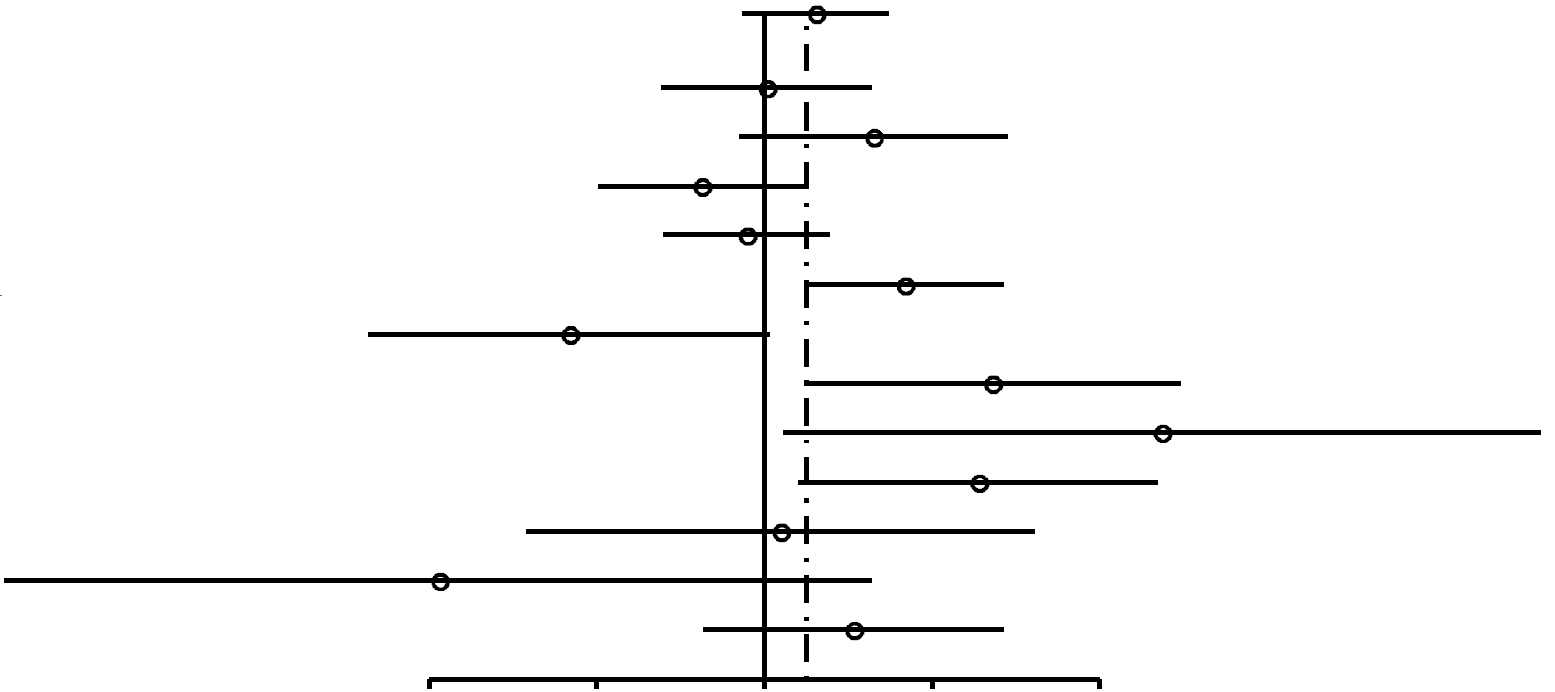 |
| Wingo,72 1993* | 147/96 | 79/52 | 1,01 (0,65-1,56) | 0,94 | |
| Wingo,72 1993† | 107/161 | 22/52 | 1,57 (0,9-2,74) | 0,14 | |
| Ursin,70 1999 | 216/227 | 58/47 | 0,77 (0,5-1,18) | 0,28 | |
| Rosenberg,75 1996* | 99/122 | 153/175 | 0,93 (0,66-1,31) | 0,73 | |
| Rosenberg,75 1996† | 74/173 | 51/213 | 1,79 (1,19-2,69) | 0,0071 | |
| Paul,63 1990 | 26/127 | 11/24 | 0,45 (0,2-1,02) | 0,09 | |
| Palmer,62 1995 | 20/23 | 21/62 | 2,57 (1,18-5,58) | 0,028 | |
| Olsson,61 1989 | 18/33 | 2/19 | 5,18 (1,08-24,81) | 0,055 | |
| Meirik,57 1986 | 44/40 | 15/33 | 2,42 (1,15-5,1) | 0,031 | |
| McPherson,56 1987 | 26/27 | 9/10 | 1,07 (0,38-3,06) | 0,89 | |
| Ewertz,47 1992 | 10/11 | 7/2 | 0,26 (0,04-1,56) | 0,27 | |
| UK National,45 1989 | 138/113 | 22/26 | 1,44 (0,78-2,68) | 0,32 | |
| |
Cas/Témoins |
|
|
0,250,51,02,04,0 | |
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | |
|
1,29 (0,85-1,96) | 0,24 | 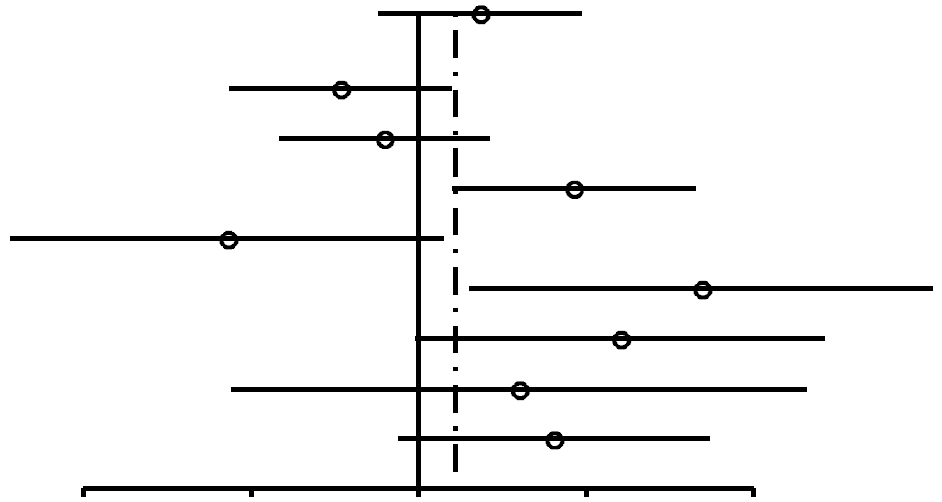 |
| Ursin,70 1999 | 117/131 | 58/47 | 0,72 (0,46-1,14) | 0,21 | |
| Rosenberg,75 1996* | 47/62 | 153/175 | 0,87 (0,56-1,34) | 0,60 | |
| Rosenberg,75 1996† | 35/77 | 51/213 | 1,9 (1,15-3,14) | 0,017 | |
| Paul,63 1990 | 16/77 | 11/24 | 0,45 (0,18-1,11) | 0,13 | |
| Palmer,62 1995 | 12/11 | 21/62 | 3,22 (1,24-8,38) | 0,028 | |
| Meirik,57 1986 | 23/22 | 15/33 | 2,3 (0,99-5,36) | 0,084 | |
| McPherson,56 1987 | 15/11 | 9/10 | 1,52 (0,46-4,98) | 0,70 | |
| UK National,45 1989 | 105/71 | 22/26 | 1,75 (0,92-3,32) | 0,12 | |
| 0,250,51,02,04,0 | |||||
|
FIGURE
2. Résumé des estimations du risque de cancer du
sein chez des femmes préménopausées
nullipares et des femmes de moins de 50 ans associé aux
antécédents d'utilisation de contraceptifs
oraux (CO). |
|||||
DISCUSSION
Les résultats de cette méta-analyse suggèrent que l'utilisation de CO est associée à une augmentation du risque de cancer du sein chez les femmes préménopausées ou les femmes de moins de 50 ans. Les femmes unipares/multipares ayant utilisé des CO avant la PGMT semblent affronter le risque le plus élevé.
Nos résultats sont cohérents avec d'autres méta-analyses antérieures et avec des analyses regroupées des études menées principalement au cours des années 70 et 80. Thomas12 a constaté une augmentation de 40% du risque (RC, 1,4; 95% IC, 1,2-1,7) chez les femmes préménopausées et postménopausées ayant utilisé des CO avant la PGMT. Des études axées sur de jeunes femmes qui ont subi une exposition prolongée aux CO (des femmes préménopausées ou des femmes de moins de 50 ans) ont aussi révélé des risques accrus. Rushton et Jones15 ont constaté que, lors de l'analyse des études menées avant 1982 (RC, 0,90; 95% IC, 0,77-1,05), les femmes de moins de 45 ans qui utilisaient des CO ne semblaient pas subir un risque plus élevé de cancer du sein. Cependant, en analysant des études conduites après 1982, il est possible de constater un risque faible, quoique significatif (RC, 1,25; 95% IC, 1,15-1,36). Delgado-Rodríguez et al14 ont analysé des études réalisées entre 1966 et 1990 et ont mesuré un RC de 1,60 (95% IC, 1,14-2,24) pour les femmes préménopausées qui avaient utilisé des CO pendant 96 mois ou plus avant la PGMT. Romieu et al10 ont constaté que les femmes de moins de 46 ans qui avaient utilisé des CO pendant 4 ans ou plus avant la PGMT ont augmenté de 72% leur risque de développer un cancer du sein (RC, 1,72; 95% IC, 1,36-2,19).
Nos résultats diffèrent, d'une certaine façon, de ceux obtenus par l'analyse regroupée Oxford.83 Premièrement, l'étude Oxford a conclu que les femmes qui avaient commencé à utiliser des CO avant l'âge de 20 ans montraient des risques relatifs plus élevés que les femmes ayant commencé à en utiliser après cet âge. Cette conclusion semble conforter nos résultats vis-à-vis de l'augmentation du risque chez les femmes unipares/ multipares avant la PGMT, étant donné qu'il est probable qu'un bon nombre de femmes ayant pris des CO avant l'âge de 20 ans l'aient fait avant la PGMT. De surcroît, l'étude Oxford a montré que les femmes unipares/multipares qui avaient utilisé des CO dans les 4 années préalables à leur recrutement dans l'étude et avant la PGMT montraient un risque significativement accru (risque relatif, 1,30 pour une utilisation actuelle et 1,36 pour une dernière utilisation 1 à 4 ans auparavant).83
| |
Cas/Témoins |
|
|
|
|
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | 1,29 (1,2-1,4) | 8,4x 10–11 | 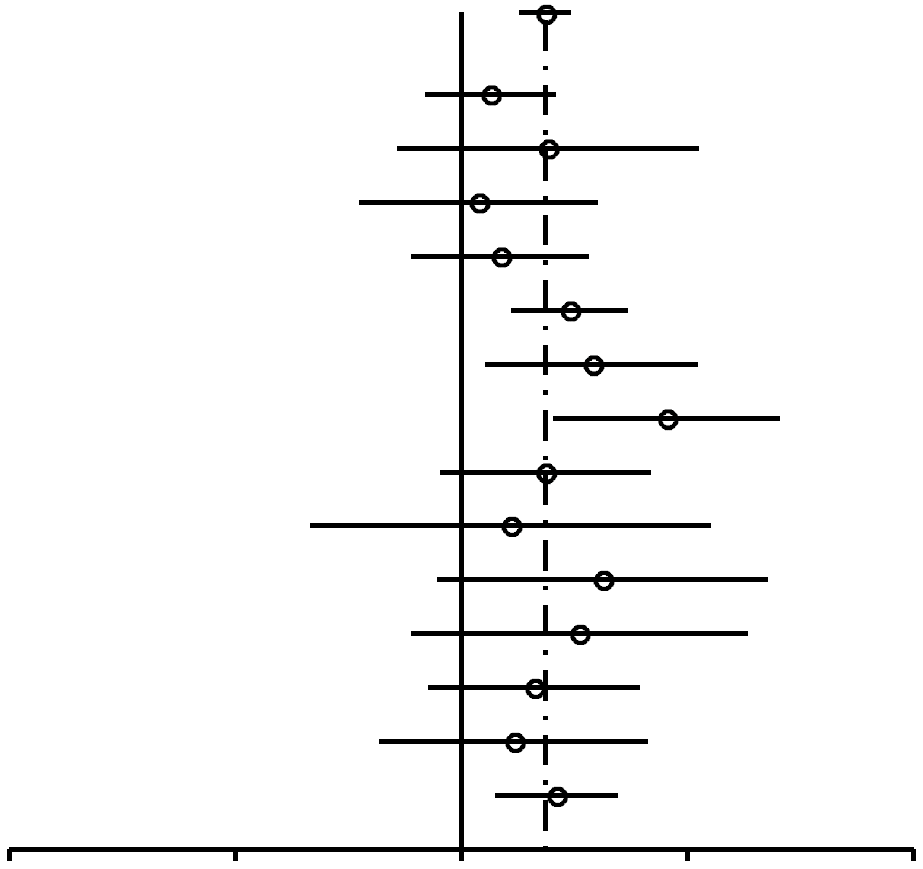 |
||
| Wingo,721993* | 949/858 | 249/246 | 1,09 (0,9-1,33) | 0,41 | |
| Wingo,721993† | 317/383 | 33/52 | 1,3 (0,82-2,07) | 0,31 | |
| Ursin,701999 | 402/399 | 66/69 | 1,05 (0,73-1,52) | 0,85 | |
| Tavani,301999 | 176/163 | 273/285 | 1,13 (0,86-1,48) | 0,42 | |
| Rosenberg,751996* | 389/460 | 464/765 | 1,39 (1,17-1,66) | 0,00029 | |
| Rosenberg,751996† | 132/265 | 83/249 | 1,49 (1,08-2,07) | 0,019 | |
| Palmer,621995 | 99/199 | 79/298 | 1,88 (1,33-2,65) | 0,00046 | |
| Meirik,571986 | 282/331 | 81/123 | 1,29 (0,94-1,79) | 0,14 | |
| Marubini,541988 | 66/72 | 26/33 | 1,16 (0,63-2,15) | 0,74 | |
| Gomes,481995 | 35/60 | 64/169 | 1,54 (0,93-2,56) | 0,12 | |
| Ewertz,471992 | 154/149 | 31/43 | 1,43 (0,86-2,4) | 0,21 | |
| Clavel,461991 | 185/175 | 115/136 | 1,25 (0,9-1,73) | 0,20 | |
| UK National,45 1989 | 550/562 | 45/54 | 1,17 (0,78-1,77) | 0,51 | |
| Brinton,431995 | 965/848 | 274/322 | 1,34 (1,11-1,61) | 0,0025 | |
| |
Cas/Témoins |
|
|
0,250,51,02,04,0 | |
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | 1,15 (1,06-1,26) | 0,0015 | 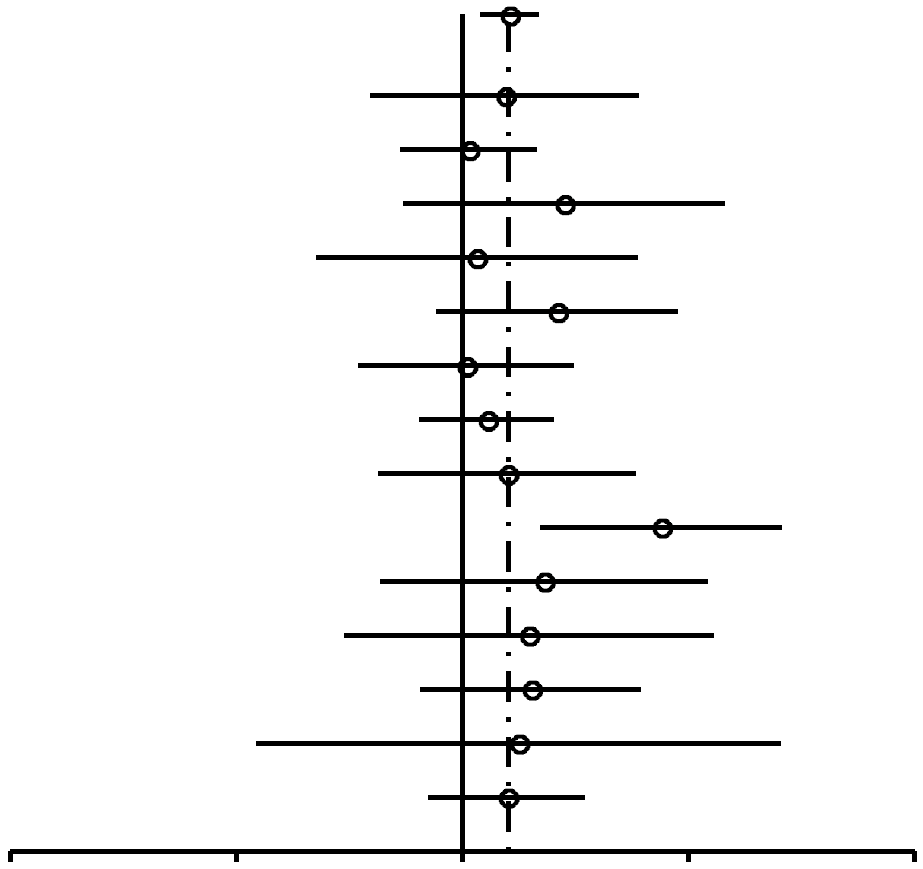 |
||
| Yuan,741988 | 68/71 | 122/145 | 1,14 (0,76-1,72) | 0,61 | |
| Wingo,721993* | 631/611 | 249/246 | 1,02 (0,83-1,26) | 0,89 | |
| Wingo,721993† | 137/158 | 33/52 | 1,37 (0,84-2,24) | 0,26 | |
| White,731994 | 149/193 | 34/46 | 1,04 (0,64-1,71) | 0,96 | |
| Weinstein,711991 | 101/92 | 124/151 | 1,34 (0,92-1,93) | 0,15 | |
| Tavani,301999 | 95/98 | 273/285 | 1,01 (0,73-1,4) | 0,99 | |
| Rosenberg,751996* | 219/335 | 464/765 | 1,08 (0,88-1,32) | 0,51 | |
| Rosenberg,751996† | 57/149 | 83/249 | 1,15 (0,77-1,7) | 0,56 | |
| Palmer,621995 | 76/156 | 79/298 | 1,84 (1,27-2,66) | 0,0016 | |
| Olsson,611989 | 60/179 | 29/111 | 1,28 (0,78-2,12) | 0,40 | |
| Ewertz,471992 | 68/77 | 31/43 | 1,22 (0,7-2,16) | 0,58 | |
| Clavel,461991 | 148/142 | 115/136 | 1,23 (0,88-1,73) | 0,26 | |
| Chie,441998 | 10/21 | 73/182 | 1,19 (0,53-2,64) | 0,83 | |
| Brinton,431995 | 240/246 | 274/322 | 1,15 (0,9-1,46) | 0,29 | |
| 0,250,51,02,04,0 | |||||
|
FIGURE
3. Résumé des estimations du risque de cancer du
sein chez des femmes unipares/multipares préménopausées
et des femmes de moins de 50 ans associé à
l'utilisation de contraceptifs oraux (CO). |
|||||
L'analyse regroupée Oxford a également conclu que les femmes ayant utilisé des CO n'affichaient pas de risque accru de cancer dix ans après la dernière utilisation (c'est-à-dire qu'ils ont trouvé le risque le plus élevé chez les utilisatrices de CO actuelles ou récentes). Cette étude a aussi conclu que, chez les femmes ayant utilisé des CO, le cancer était moins avancé que chez les femmes non utilisatrices. Deux distinctions sont à noter à l'égard de ces conclusions. Premièrement, ces résultats ne peuvent pas être directement comparés aux nôtres en raison des différents paramètres retenus lors de nos analyses. Nous nous sommes focalisés sur le risque associé à l'utilisation précoce de CO chez la femme préménopausée, à partir d'études cas-témoins groupant des cas ayant développé un cancer du sein principalement après 1980 ; l'exclusion de 4 études (sur 39) dont les données avaient été recueillies avant 1980 n'a pas altéré nos résultats (données non affichées). Les conclusions de l'étude Oxford sur ces points de référence étaient fondées sur l'utilisation de CO aussi bien par les femmes préménopausées que postménopausées ; dans cette analyse, deux tiers des femmes atteintes de cancer du sein avaient plus de 45 ans.84 En outre, les auteurs ont inclus plusieurs études cas-témoins dont la base de données contenait principalement des femmes ayant développé un cancer du sein avant 1980.19-25,65
| |
Cas/Témoins |
|
|
|
|
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | 1,44 (1,28-1,62) | 8,1× 10–10 | 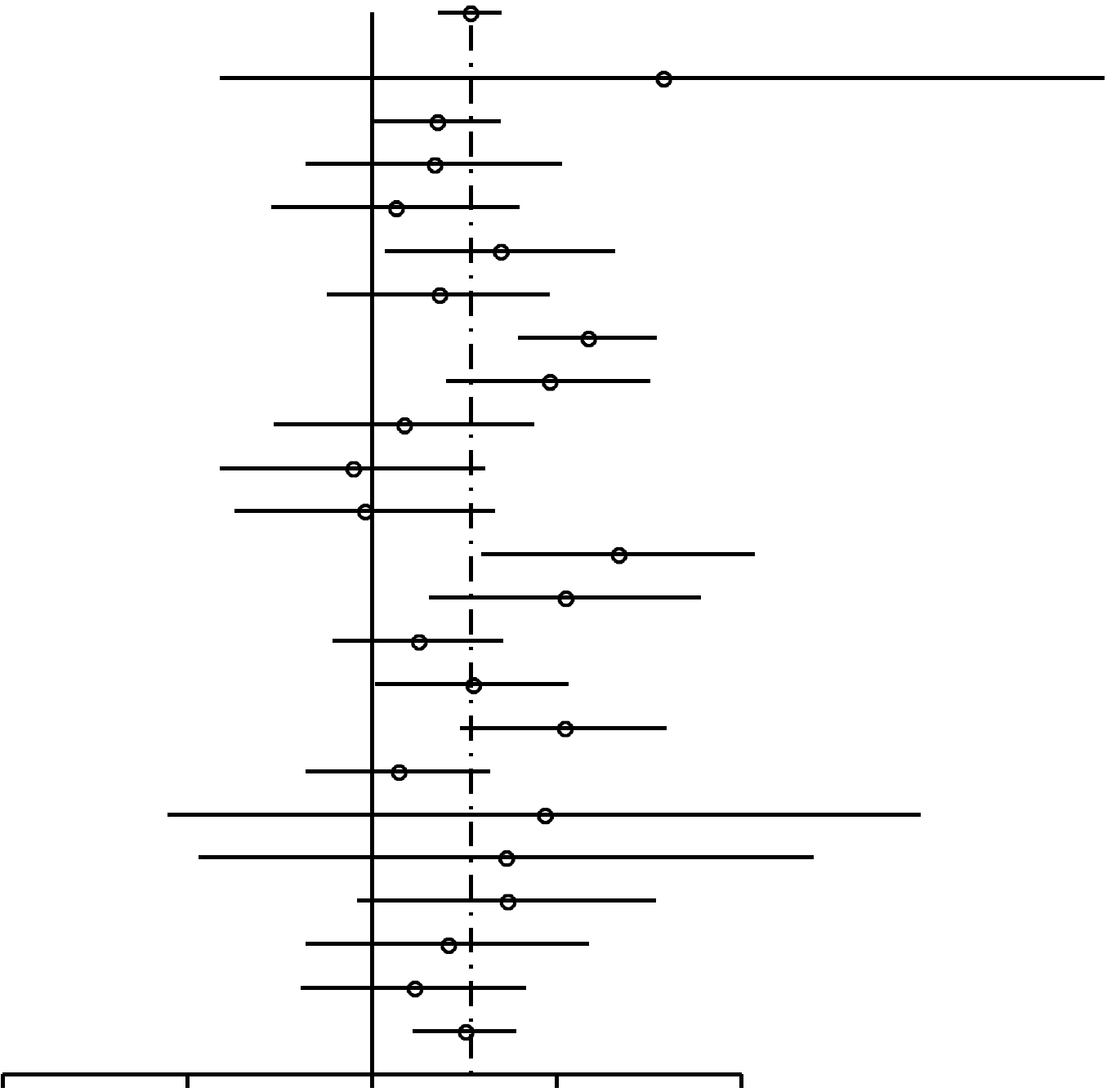 |
||
| Yuan,74 1988 | 5/2 | 122/145 | 2,97 (0,57-15,59) | 0,34 | |
| Wingo,72 1993* | 318/247 | 249/246 | 1,27 (1-1,62) | 0,059 | |
| Wingo,72 1993† | 180/225 | 33/52 | 1,26 (0,78-2,03) | 0,41 | |
| White,73 1994 | 363/450 | 34/46 | 1,09 (0,69-1,74) | 0,80 | |
| Weinstein,71 1991 | 69/52 | 124/151 | 1,62 (1,05-2,49) | 0,038 | |
| Tavani,30 1999 | 59/48 | 273/285 | 1,28 (0,85-1,94) | 0,28 | |
| Rosenberg,75 1996* | 170/125 | 464/765 | 2,24 (1,73-2,9) | 1,0 × 10–9 | |
| Rosenberg,75 1996† | 75/116 | 83/249 | 1,94 (1,32-2,84) | 0,0009 | |
| Rookus,65 1994 | 267/279 | 34/40 | 1,13 (0,69-1,83) | 0,72 | |
| Primic-Zakelj,64 1995 | 33/37 | 288/300 | 0,93 (0,57-1,53) | 0,87 | |
| Paul,63 1990 | 137/535 | 24/91 | 0,97 (0,6-1,58) | 0,99 | |
| Palmer,62 1995 | 32/48 | 79/298 | 2,51 (1,51-4,19) | 0,00054 | |
| Olsson,61 1989 | 63/117 | 29/111 | 2,06 (1,24-3,44) | 0,0075 | |
| Moorman,58 2001 | 221/173 | 129/120 | 1,19 (0,86-1,63) | 0,33 | |
| Meirik,57 1986 | 143/149 | 81/123 | 1,46 (1,01-2,09) | 0,052 | |
| McPherson,56 1987 | 90/51 | 226/263 | 2,05 (1,4-3,02) | 0,00033 | |
| McCredie,55 1998 | 239/185 | 102/87 | 1,1 (0,78-1,56) | 0,64 | |
| Lee,51 1992 | 4/4 | 87/166 | 1,91 (0,47-7,82) | 0,59 | |
| Gomes,48 1995 | 5/8 | 64/169 | 1,65 (0,52-5,23) | 0,59 | |
| Ewertz,47 1992 | 86/72 | 31/43 | 1,66 (0,95-2,9) | 0,10 | |
| Clavel,46 1991 | 37/33 | 115/136 | 1,33 (0,78-2,26) | 0,36 | |
| UK National,45 1989 | 348/357 | 45/54 | 1,17 (0,77-1,78) | 0,53 | |
| Brinton,43 1995 | 725/602 | 274/322 | 1,42 (1,17-1,72) | 0,00053 | |
| |
Cas/Témoins |
|
|
0,250,51,02,04,0 | |
| Référence | Utilisatrices de CO |
Non utilisatrices de CO |
RC (95% IC) | Valeur p | |
| Toutes | 1,52 (1,26-1,82) | 1,0 × 10–5 | 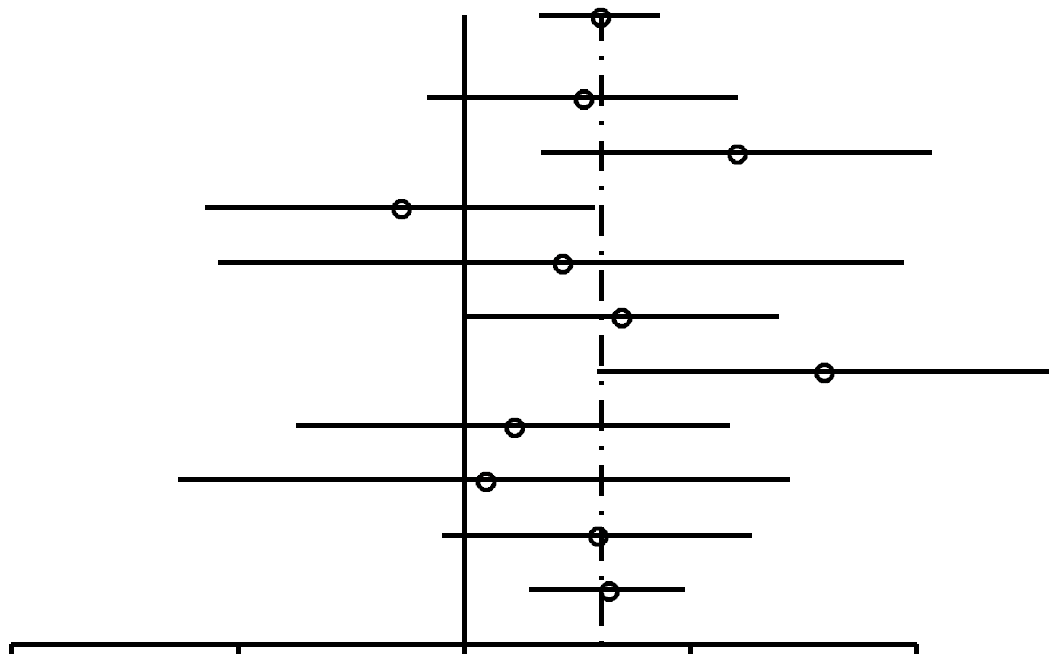 |
||
| Rosenberg,75 1996* | 34/39 | 464/765 | 1,44 (0,9-2,31) | 0,17 | |
| Rosenberg,75 1996† | 23/30 | 83/249 | 2,3 (1,27-4,18) | 0,0089 | |
| Paul,63 1990 | 31/143 | 24/91 | 0,82 (0,45-1,49) | 0,62 | |
| Palmer,62 1995 | 5/14 | 79/298 | 1,35 (0,47-3,85) | 0,79 | |
| Meirik,57 1986 | 51/48 | 81/123 | 1,61 (1-2,62) | 0,069 | |
| McPherson,56 1987 | 31/12 | 226/263 | 3,01 (1,51-5,99) | 0,002 | |
| Ewertz,47 1992 | 31/37 | 31/43 | 1,16 (0,6-2,26) | 0,78 | |
| Clavel,46 1991 | 9/10 | 115/136 | 1,06 (0,42-2,71) | 0,91 | |
| UK National,45 1989 | 129/103 | 45/54 | 1,5 (0,94-2,41) | 0,12 | |
| Brinton,43 1995 | 296/224 | 274/322 | 1,55 (1,23-1,97) | 0,00033 | |
| 0,250,51,02,04,0 | |||||
|
FIGURE
4. Résumé des estimations du risque de cancer du
sein chez des femmes préménopausées
unipares/multipares et des femmes de moins de 50 ans associé
à l'utilisation de contraceptifs oraux (CO). |
|||||
Deuxièmement, nous n'avons pas réussi à obtenir de données concernant la période d'utilisation de CO (à savoir, utilisation actuelle, récente ou 10 ans après la dernière utilisation) pour le sous-groupe spécifique de femmes unipares/multipares préménopausées ayant utilisé des CO avant la PGMT. L'épidémiologie de l'utilisation des CO pourrait expliquer la conclusion de l'étude Oxford selon laquelle les risques étaient plus élevés chez les utilisatrices actuelles ou récentes. Dans leur analyse, les utilisatrices actuelles ou récentes auraient été plus enclines à l'utilisation des CO dans les décennies plus récentes que celles qui en avaient utilisé pour la dernière fois il y a plus de 10 ans. Nous avons observé dès le départ que les femmes utilisaient des CO pendant des périodes plus prolongées avant la PGMT dans des décennies plus récentes (p.ex. les années 1980 et 1990) par rapport aux décennies précédentes (p.ex. les années 1960 et 1970) ; par conséquent, le risque accru chez les utilisatrices actuelles ou récentes, identifié dans l'analyse Oxford, peut refléter le risque accru associé à une utilisation plus prolongée de CO avant la PGMT, tel que nous avons observé.
Nous avons constaté que le risque chez les femmes unipares/multipares qui avaient pris des CO avant la PGMT (RC, 1,44; 95% IC, 1,28-1,62) était plus élevé que chez les femmes nullipares qui prenaient aussi des CO (RC, 1,24; 95% IC, 0,92-1,67). Nous ne connaissons pas la raison de cette différence.
Nous avons subdivisé intentionnellement notre analyse en différents sous-groupes (par exemple, unipares/ multipares et nullipares). Nous croyons que cette différentiation était nécessaire car les femmes nullipares peuvent présenter plus souvent des facteurs potentiels de risque (par exemple, infertilité, utilisation de médicaments contre l'infertilité, syndrome des ovaires polykystiques) que les femmes unipares/multipares.
Notre analyse s'ajoute à l'ensemble de la littérature existante dans ce domaine en se concentrant sur les études menées à partir de 1980 et portant sur l'effet des CO sur le cancer du sein chez la femme préménopausée. Les résultats des études antérieures ainsi que ceux des nôtres sont cohérents avec l'hypothèse selon laquelle les CO peuvent être cancérigènes, notamment lorsqu'ils sont utilisés avant la PGMT. Le sein de la femme nullipare est formé de structures indifférenciées, et c'est uniquement pendant une grossesse menée à terme que le sein atteint son développement maximal.16 Ce développement a lieu en deux phases distinctes : une phase précoce de croissance et une phase tardive de différenciation lobulaire.16 Les structures indifférenciées retrouvées dans le sein de la femme nullipare peuvent être plus sensibles aux carcinogènes que les structures plus différenciées retrouvées dans le sein complètement différencié. Par exemple, les femmes nullipares de Hiroshima et de Nagasaki (Japon) exposées au rayonnement de la bombe atomique ont développé un cancer du sein beaucoup plus fréquemment que les femmes qui avaient déjà accouché d'enfants au moment de l'exposition86. Bien qu'il ne soit pas possible d'établir directement le potentiel cancérigène des CO sur le tissu mammaire humain in vivo, des études menées chez des animaux suggèrent que les hormones contenues dans les CO possèdent un potentiel cancérigène chez les rongeurs, les chiens et les singes.87-92 De plus, les CO accélèrent le taux de division des cellules mammaires chez les femmes qui en prennent avant la PGMT.93 Des augmentations des taux de division cellulaire sont associées à un risque accru de cancer.94-96 De surcroît, il est prouvé que les CO agissent parfois en provoquant un effet post-fécondation (c'est-à-dire qu'ils empêchent parfois la nidation après que la fécondation a eu lieu).97 Si cet effet est associé à des changements hormonaux précoces, comme certaines données le suggèrent,98,99 cela pourrait être un mécanisme alternatif de l'effet cancérigène des CO, particulièrement s'ils sont utilisés avant la PGMT.
Il faut considérer un certain nombre de questions méthodologiques pour interpréter nos résultats soit individuellement soit comparativement avec des travaux préalables. Premièrement, nous avons choisi la méthode des effets aléatoires pour mener cette méta-analyse parce que nous nous attendions à une différentiation significative des études en fonction de plusieurs facteurs, tels que la durée et le mode d'utilisation de CO et la période de latence disponible. Ces facteurs seraient susceptibles d'affecter les RC mesurés. Deuxièmement, le fait que les populations de l'étude différaient significativement quant aux races et aux cultures, ces deux facteurs pourraient aboutir à des différences de biais, et avoir en plus des effets directs. Par conséquent, bien que nous considérions que la preuve de l'association entre l'utilisation de CO et le cancer est solide, nous ne prétendons pas en observer l'effet dans chacune des études comprises dans notre analyse. Or, bien qu'il soit biologiquement invraisemblable que l'utilisation de CO augmente le risque et, en même temps, protège contre le cancer chez la femme préménopausée, les différences relevées dans la conception des études, la variabilité, les caractéristiques des patientes ainsi que dans les dispositifs de mesure pourraient faire qu'une étude individuelle trouve une association semblant contredire les données collectives disponibles ; ainsi, nous considérons que l'étude de Traina et al69 (RC, 0,61; P = 0,005) est atypique (bien que nous l'ayons incluse dans notre analyse). Pour interpréter les résultats de notre méta-analyse, il est important de comprendre les méthodes et leurs limites. Le postulat de base sous-jacent au modèle d'effets aléatoires tient en ce que les études analysées constituent un échantillon aléatoire d'une grande population d'études ; le RC moyen de la population d'études est µ et son erreur (avec distribution normale) est s. La méta-analyse fournit des estimations de µ et de s, et c'est à partir de ces dernières que nous déterminons l'IC pour µ et la valeur P de non association entre l'utilisation de CO et le cancer. Comme nous l'avons indiqué ci-dessus, nous ne nous attendions pas à ce que les RC soient inférieurs et supérieurs à 1, à moins que le biais ne joue un rôle significatif ; par conséquent, la supposition que µ soit normalement distribué constitue une limitation de l'étude. Nous remarquons aussi que l'IC calculé dans le modèle d'effets aléatoires et la valeur P qui lui est associée devraient être interprétés avec prudence au moment d'évaluer l'association entre l'utilisation de CO et le cancer ; le modèle d'effets aléatoires estime les propriétés de la moyenne RC de la population, mais certaines sous populations évaluées dans les études considérées dans cette méta-analyse pourraient courir un risque beaucoup plus élevé que d'autres.
Certaines questions additionnelles sur la conception de notre étude doivent être notées. Premièrement, en choisissant d'analyser des études menées auprès de femmes préménopausées, publiées depuis 1980 inclus, nous avons structuré notre analyse de façon à y inclure une grande quantité de femmes exposées aux CO avant la PGMT, ce qui nous a permis de maximiser la période potentielle de latence entre l'exposition aux CO et l'apparition du cancer du sein.100-103 Il était improbable que le groupe des femmes postménopausées incluses dans des études conduites jusqu'en 1995 comporte un grand nombre de femmes exposées aux CO avant PGMT. D'ailleurs, il existe des précédents sur l'importance d'une période de latence suffisante entre l'exposition et le développement ultérieur du cancer du sein. Les survivantes des radiations de la bombe atomique ont montré une augmentation liée à la dose de l'incidence du cancer du sein qui fut perçue pour la première fois quinze ans après l'exposition,86 et le lien entre l'utilisation du diéthylstilbestrol et le risque postérieur de cancer ne devint évident qu'après plus de 22 ans.104 Par conséquent, la plupart des études préalables10,11,13,14 analysant des données d'études menées avant 1980 ne peuvent pas inclure une période de temps suffisante entre l'exposition aux CO et le développement postérieur du cancer du sein.
Une deuxième question concerne le changement relativement rapide de l'âge de première utilisation de CO durant les dernières décennies. A partir de la fin des années 1970, les femmes ont utilisé des CO à des âges plus précoces et pendant des périodes plus prolongées que les femmes d'âge reproductif comparable dans les années 1960 et au début des années 197011. C'est pour cela que les études doivent combiner soigneusement les cas et les témoins en fonction de l'âge, de façon à ce que les distributions des cas et des témoins par groupe d'âge soient similaires. Autrement, toute association potentielle peut être voilée. Par exemple, si la taille de l'échantillon des témoins dans la catégorie des plus jeunes est plus large que celle des cas de la même catégorie, le groupe témoin possèdera sûrement plus de femmes faisant une utilisation plus précoce et prolongée de CO, ce qui conduira à une sous-estimation du RC. Singulièrement, cette concentration ou ce regroupement des témoins par rapport aux cas dans le groupe des femmes jeunes a lieu dans un bon nombre d'études examinant l'utilisation de CO et le risque de cancer du sein. Parmi les 34 études incluses dans notre méta-analyse, un total de 18 étude30,43,45,46,48,50-52,55-57,60,62,63,69,72,73,75 fournissent des informations sur la fréquence de distribution de l'âge des cas et des témoins. 11 de ces dernières (61%)30,43,46,50,60,62,63,69,72,73,75 montrent un effet de concentration dans le groupe contrôle. Même si les études individuelles peuvent redresser ce facteur potentiel de confusion en ajustant l'âge des participantes dans leurs analyses ou en analysant leurs données par groupes d'âge plus étroits, nous n'avons pas pu le faire en raison de l'absence de données individuelles sur les participantes de chaque étude. D'ailleurs, étant donné qu'un bon nombre d'études individuelles n'ont pas effectué d'analyse stratifiée selon le nombre d'enfants nés (0, 1, multipares) ou selon l'utilisation de CO par rapport à la PGMT, nous avons seulement pu utiliser des estimations brutes (plutôt qu'ajustées) dans notre analyse. Toutefois, en ce qui concerne au moins les analyses non stratifiées (qui sont les seules analyses pour lesquelles nous avons réussi à obtenir des RC ajustés), la plupart des RC bruts relatifs à l'utilisation de CO chez les femmes unipares/multipares avant la PGMT que nous avons calculés sont similaires aux RC ajustés rapportés par les auteurs originaux.30,43,45-47,51,55-57,61-63,66,71-73
Le biais du survivant, c'est-à-dire, l'exclusion des femmes avec un cancer du sein plus agressif, qui pourraient être trop malades ou décéder avant leur inclusion dans l'étude reste une considération importante, étant donné que l'utilisation de CO tôt dans la vie est associée à une forme plus agressive de la maladie.105-108 Parmi les 13 études43-46,50,52,55,57,59,60,63,65,73 ayant rapporté des données appropriées, un total de 9 études (69%)45,50,52,55,57,59,63,65,73 ont un potentiel de biais du survivant et 445,50,59,73 sur les 9 études positives montrent que plus de 5% des patientes étaient soit trop malades pour être interviewées, soit sont mortes au cours de l'étude. Si la plupart de ces femmes étaient des utilisatrices de CO, leur exclusion des études aboutirait à des résultats qui atténueraient toute association réelle. Un effet atténué pourrait résulter aussi des études excluant les femmes les plus jeunes, telles que les femmes de 20 et de 30 ans, qui seraient plus susceptibles d'avoir utilisé des CO avant la PGMT.
La définition de l'utilisation des CO pourrait aussi affecter l'estimation du risque. En particulier, environ 30% des femmes qui prennent des CO pour la première fois cessent de les utiliser dans les six mois suivants à cause des effets indésirables ou pour d'autres raisons,109,110 et de nombreuses femmes interrompent l'utilisation au bout de 3 mois.111 Ces femmes sont souvent incluses dans la catégorie des utilisatrices ou dans celle des utilisatrices avant PGMT, quoiqu'il soit incertain que cette exposition à court terme soit associée à une augmentation du risque de cancer du sein. En conséquence, le fait de les inclure dans notre analyse a probablement atténue nos RC dérivés.
Plusieurs questions relatives à nos résultats sont susceptibles de discussion. Premièrement, étant donné que nous avons limité l'inclusion d'études à celles qui suivaient un schéma cas-témoins, il existe une possibilité de biais de souvenir qui ferait surdimensionner le lien entre les CO et le cancer du sein. Cependant, cette inquiétude a été clairement abordée dans la littérature : 3 études indépendantes ont comparé les souvenirs des patientes avec les registres de prescriptions et aucune d'entre elles n'a trouvé d'évidence d'un biais de souvenir significatif.45,65,112 La préoccupation concernant le biais de souvenir pourrait avoir été évitée en utilisant des études prospectives ; cependant, nous n'avons pas inclus d'études prospectives dans notre analyse parce qu'il existe peu d'information prospective sur la période d'utilisation des CO et le cancer du sein chez les femmes unipares/ multipares préménopausées. Nous avons identifié 17 études prospectives113-129 (Table 2). Deux de ces études114,115 examinent les risques des CO uniquement vis-à-vis d'un cancer du sein fatal. Une de ces études prend seulement des femmes avec des antécédents familiaux de cancer du sein.117 Deux de ces études, menées en Islande,125,127 ne donnent pas d'information sur l'utilisation précoce de CO parce que le registre national du cancer n'a recueilli des informations sur l'âge d'utilisation des CO qu'à partir des années 1990. Seules deux études prospectives118,129 examinent le risque d'utilisation de CO chez des femmes qui en prenaient avant la PGMT, et l'une d'entre elles seulement aborde le risque d'une utilisation prolongée avant la PGMT chez des femmes préménopausées.118 La seconde étude n'identifie que 4 femmes préménopausées de moins de 45 ans qui avaient utilisé des CO pendant 5 ans ou plus avant la PGMT, ce qui est un nombre trop petit pour en tirer des conclusions significatives. D'ailleurs, si l'utilisation de CO avant la PGMT est associée au risque de développer des cancers du sein plus agressifs 105-108, les femmes préménopausées atteintes de cancer du sein pourraient ne pas entre incluses dans les études prospectives parce qu'elles seraient absentes de la population à partir de laquelle la cohorte a été choisie en raison de leur mort précoce, ou bien elles pourraient être exclues de la cohorte originale en raison de la conception de l'étude. Ces facteurs conduiraient à une sous-estimation de tout effet réel.
|
TABLE 2. Risque de cancer du sein associé à l'utilisation de contraceptifs oraux (Études prospectives)*
*IC =
intervalle de confiance; RR = risque relatif ; †Données sur les RR
prises de l'analyse combinée Oxford.83 |
Une limitation de nos analyses réside dans le fait que nous avons utilisé des RC bruts au lieu de RC ajustés par manque de données disponibles sur les RC ajustés quant à l'exposition liée au fait d'avoir ou non des enfants, ou liée à la PGMT. En conséquence, nous n'avons pas pu contrôler les effets de facteurs potentiels de confusion tels que l'âge de la ménarche et l'âge à la première naissance. Toutefois, si certains facteurs parasites exerçaient un effet significatif, nous pourrions supposer que les RC, calculés sur la base des données brutes, seraient significativement différents des RC ajustés en fonction de l'utilisation de CO avant PGMT, rapportés dans les publications originales. Cela ne semble pas être le cas. La plupart des études30,43,45-47,51,55-57,61-63,66,71-73 ont rapporté des RC ajustés similaires aux RC bruts que nous avons calculés dans notre analyse. Cela suggère qu'il est improbable que le manque d'ajustement des facteurs potentiels de confusion ait affecté nos conclusions de manière substantielle.
Deuxièmement, nous n'avons pas pu contrôler les doses hormonales contenues dans les préparations de CO. Le contenu hormonal des CO a changé au cours des années et les résultats d'études dans lesquelles les femmes avaient été exposées principalement à des CO contenant des doses élevées d'oestrogènes et de progestines peuvent ne pas être extrapolables aux CO à faibles doses. Bien que les CO à faibles doses comportent un moindre risque de thrombose que les CO à doses élevées, les CO à faibles doses ont été associés à un risque plus élevé de cancer du sein par rapport à des régimes à dose élevée.21,60,65 Par example, l'analyse combinée Oxford a rapporté un risque plus élevé de cancer du sein métastatique chez les femmes qui prenaient des CO triphasiques à faible dose par rapport aux consommatrices de CO monophasiques à doses élevées11. La cause de cette contradiction apparente reste inconnue, mais il est probable que cela soit dû aux progestines plus puissantes utilisées dans les nouveaux CO. Bien que les progestines liées à la noréthindrone (p.ex. noréthindrone, noréthynodrel, ethynodiol) aient été utilisées exclusivement dans les années 1960 et 1970, les gonanes (p.ex. désogestrel, norgestrel, norgestimate), qui sont bien plus puissants que leurs prédécesseurs,130 ont été utilisés plus fréquemment dès la fin de la décennie 1970. Les taux de progestérone s'élèvent lors de la phase lutéale et l'on suppose qu'ils sont responsables de l'augmentation du taux de division des cellules mammaires.131 Les contraceptifs oraux entraînent une hyperstimulation de la division des cellules mammaires dans les seins de la femme nullipare et ils exercent leur effet le plus important lors de la phase lutéale, lorsque les doses de progestines contenues dans les CO triphasiques à faible dose sont maximales93. Les progestines de synthèse semblent augmenter le risque de cancer du sein. Skegg et al132 ont remarqué que les femmes jeunes en âge reproductif utilisant l'acétate de médroxyprogestérone injectable pendant 3 ans ou plus, avaient 190% plus de risque d'être atteintes du cancer du sein (risque relatif, 2,9, 95% IC, 1,2-7,1). Récemment, la Women's Health Initiative a rapporté que les femmes sélectionnées au hasard pour recevoir une combinaison oestrogène-progestine avaient un risque accru de cancer du sein8, tandis que les femmes qui recevaient uniquement des oestrogènes ne montraient pas d'augmentation du risque133. De cette façon, il est possible que le type et la dose de progestine contenue dans les CO puisse affecter le risque de cancer du sein.
Troisièmement, nous avons noté, dès le départ, qu'il n'était pas possible d'obtenir des données spécifiques concernant la durée depuis la dernière utilisation pour les femmes unipares/multipares préménopausées qui utilisaient des CO avant la PGMT. Nous pensons tout de même qu'il est raisonnable de supposer que la plupart des femmes préménopausées qui ont pris des CO avant la PGMT l'avaient fait il y a au moins dix ans, étant donné que la femme nord-américaine moyenne continue de prendre des CO pendant 5 ans environ.134 Dans l'avenir, la définition de la durée depuis la dernière utilisation de CO peut être troublée dans la mesure où davantage de femmes périménopausées utilisent de nouveaux régimes de CO à faible dose à des fins non contraceptives. Il faut également considérer que nous avons inclus toutes les études retrouvées dans la littérature sans appliquer aucun critère d'évaluation de la qualité. Cela pourrait expliquer certaines des hétérogénéités observées dans notre analyse et pourrait biaiser nos conclusions vers l'hypothèse nulle. Bien que nous ayons remarqué une certaine hétérogénéité dans les études limitées aux femmes nullipares, nous n'avons pas pu identifier la cause d'une telle hétérogénéité. Le biais de publication pourrait affecter aussi nos résultats, quoique l'étude la plus petite incluse dans notre analyse ait eu seulement 200 patientes et que la construction d'un graphique en entonnoir n'ait montré aucune évidence de biais de publication (données non publiées).
CONCLUSION
En harmonie avec la classification récente du Centre International de Recherche sur le Cancer, selon lequel les CO sont des carcinogènes du groupe 1, cette méta-analyse suggère que les CO sont associées à une augmentation du risque de cancer du sein chez les femmes préménopausées, et notamment chez les femmes utilisant des CO avant la PGMT.
Nous remercions le Dr Joseph Stanford pour son aide dans la rédaction du manuscrit, ainsi que Chandra Marriott, MPH, et Claudia Leiras, MS, pour leur collaboration dans la révision et l'abstraction des données.
RÉFÉRENCES
1. Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005 [une correction publiée a paru dans CA Cancer J Clin. 2005;55:259]. CA Cancer J Clin. 2005;55:10-30.
2. Breast cancer facts and figures 2003-2004. Atlanta
(GA): American Cancer
Society; c2003. Disponible sur
http://www.cancer.org/etc..
Accédé le 5 septembre 2006. [URL actualisée en avril 2011.]
3. Ries LAG, Eisner MP, Kosary CL, et al, eds. SEER Cancer Statistics Review, 1973-1999. Bethesda (MD): National Cancer Institute; 2002. Disponible sur : http://seer.cancer.gov/csr/1973_1999/. Accédé le 5 septembre 2006.
4. Newcomb PA, Storer BE, Longnecker MP, et al. Lactation and a reduced risk of premenopausal breast cancer. N Engl J Med. 1994;330:81-87.
5. McTiernan A, Thomas DB. Evidence for a protective effect of lactation on risk of breast cancer in young women: results from a case-control study. Am J Epidemiol. 1986;124:353-358.
6. Lowe CR, MacMahon B. Breast cancer and reproductive history of women in South Wales. Lancet. 1970;1:153-156.
7. Mirra AP, Cole P, MacMahon B. Breast cancer in an area of high parity: Sao Paulo, Brazil. Cancer Res. 1971;31:77-83.
8. Chlebowski RT, Hendrix SL, Langer RD, et al, WHI Investigators. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women's Health Initiative Randomized Trial. JAMA. 2003;289:3243-3253.
9. Centre International de Recherche sur le Cancer de l'OMS (CIRC). Le programme des monographies du CIRC classe les contraceptifs oestroprogestatifs et l'hormonothérapie ménopausique comme cancérogènes [communiqué de presse 167]. 29 juillet 2005. Accédé le 1er septembre 2006. Disponible ici [URL actualisée en avril 2011.]
10. Romieu I, Berlin JA, Colditz G. Oral contraceptives and breast cancer: review and meta-analysis. Cancer. 1990;66:2253-2263.
11. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: further results. Contraception. 1996;54(suppl): 1S-106S.
12. Thomas DB. Oral contraceptives and breast cancer: review of the epidemiologic literature. Contraception. 1991;43:597-642.
13. Hawley W, Nuovo J, DeNeef CP, Carter P. Do oral contraceptive agents affect the risk of breast cancer? A meta-analysis of the case-control reports. J Am Board Fam Pract. 1993;6:123-135.
14. Delgado-Rodriguez M, Sillero-Arenas M, Rodriguez-Contreras R, Lopez Gigosos R, Galvez Vargas R. Oral contraceptives and breast cancer: a meta-analysis. Rev Epidemiol Sante Publique. 1991;39:165-181.
15. Rushton L, Jones DR. Oral contraceptive use and breast cancer risk: a meta-analysis of variations with age at diagnosis, parity and total duration of oral contraceptive use. Br J Obstet Gynaecol. 1992;99:239-246.
16. Russo J, Hu YF, Silva ID, Russo IH. Cancer risk related to mammary gland structure and development. Microsc Res Tech. 2001;52:204-223.
17. Kelsey JL. A review of the epidemiology of human breast cancer. Epidemiol Rev. 1979;1:74-109.
18. Helmrich SP, Shapiro S, Rosenberg L, et al. Risk factors for breast cancer. Am J Epidemiol. 1983;117:35-45.
19. Ross RK, Paganini-Hill A, Gerkins VR, et al. A case-control study of menopausal estrogen therapy and breast cancer. JAMA. 1980;243:1635-1639.
20. Stanford JL, Brinton LA, Hoover RN. Oral contraceptives and breast cancer: results from an expanded case-control study. Br J Cancer. 1989;60:375-381.
21. Ursin G, Aragaki CC, Paganini-Hill A, Siemiatycki J, Thompson WD, Haile RW. Oral contraceptives and premenopausal bilateral breast cancer: a case-control study. Epidemiology. 1992;3:414-419.
22. Pike MC, Henderson BE, Krailo MD, Duke A, Roy S. Breast cancer in young women and use of oral contraceptives: possible modifying effect of formulation and age at use. Lancet. 1983;2:926-930.
23. Morabia A, Szklo M, Stewart W, Schuman L, Thomas DB. Consistent lack of association between breast cancer and oral contraceptives using either hospital or neighborhood controls. Prev Med. 1993;22:178-186.
24. Vessey M, Baron J, Doll R, McPherson K, Yeates D. Oral contraceptives and breast cancer: final report of an epidemiological study. Br J Cancer. 1983;47:455-462.
25. Schildkraut JM, Hulka BS, Wilkinson WE. Oral contraceptives and breast cancer: a case-control study with hospital and community controls. Obstet Gynecol. 1990;76:395 402.
26. Yang CP, Daling JR, Band PR, Gallagher RP, White E, Weiss NS. Noncontraceptive hormone use and risk of breast cancer. Cancer Causes Control. 1992;3:475-479.
27. Rossing MA, Stanford JL, Weiss NS, Habel LA. Oral contraceptive use and risk of breast cancer in middle-aged women. Am J Epidemiol. 1996;144:161-164.
28. Tavani A, Negri E, Franceschi S, Parazzini F, La Vecchia C. Oral contraceptives and breast cancer in northern Italy: final report from a case-control study. Br J Cancer. 1993;68:568-571.
29. La Vecchia C, Negri E, Franceschi S, et al. Oral contraceptives and breast cancer: a cooperative Italian study. Int J Cancer. 1995;60:163-167.
30. Tavani A, Gallus S, La Vecchia C, et al. Risk factors for breast cancer in women under 40 years. Eur J Cancer. 1999;35:1361-1367.
31. Sanderson M, Shu XO, Jin F, et al. Abortion history and breast cancer risk: results from the Shanghai Breast Cancer Study. Int J Cancer. 2001;92:899-905.
32. Hislop TG, Coldman AJ, Elwood JM, Brauer G, Kan L. Childhood and recent eating patterns and risk of breast cancer. Cancer Detect Prev. 1986;9:47-58.
33. Rohan TE, McMichael AJ. Oral contraceptive agents and breast cancer: a population-based case-control study. Med J Aust. 1988;149:520-526.
34. Segala C, Gerber M, Richardson S. The pattern of risk factors for breast cancer in a southern France population: interest for a stratified analysis by age at diagnosis. Br J Cancer. 1991;64:919-925.
35. Siskind V, Schofield F, Rice D, Bain C. Breast cancer and breastfeeding: results from an Australian case-control study. Am J Epidemiol. 1989;130:229-236.
36. Bustan MN, Coker AL, Addy CL, Macera CA, Greene F, Sampoerno D. Oral contraceptive use and breast cancer in Indonesia. Contraception. 1993;47:241-249.
37. Ngelangel C, Lacaya LB, Cordero C, Laudico AV. Risk factors for breast cancer among Filipino women. Philipp J Intern Med. 1994;32:231-236.
38. Ravnihar B, Primic Zakelj M, Kosmelj K, Stare J. A case-control study of breast cancer in relation to oral contraceptive use in Slovenia. Neoplasma. 1988;35:109-121.
39. Talamini R, La Vecchia C, Franceschi S, et al. Reproductive and hormonal factors and breast cancer in a Northern Italian population. Int J Epidemiol. 1985;14:70-74.
40. Wang QS, Ross RK, Yu MC, Ning JP, Henderson BE, Kimm HT. A case-control study of breast cancer in Tianjin, China. Cancer Epidemiol Biomarkers Prev. 1992;1:435-439.
41. Ellery C, MacLennan R, Berry G, Shearman RP. A case-control study of breast cancer in relation to the use of steroid contraceptive agents. Med J Aust. 1986;144:173-176.
42. Ursin G, Ross RK, Sullivan-Halley J, Hanisch R, Henderson B, Bernstein L. Use of oral contraceptives and risk of breast cancer in young women. Breast Cancer Res Treat. 1998;50:175-184.
43. Brinton LA, Daling JR, Liff JM, et al. Oral contraceptives and breast cancer risk among younger women. J Natl Cancer Inst. 1995;87:827-835.
44. Chie WC, Li CY, Huang CS, Chang KJ, Yen ML, Lin RS. Oral contraceptives and breast cancer risk in Taiwan, a country of low incidence of breast cancer and low use of oral contraceptives. Int J Cancer. 1998;77:219-223.
45. UK National Case-Control Study Group. Oral contraceptive use and breast cancer risk in young women. Lancet. 1989;1:973-982.
46. Clavel F, Andrieu N, Gairard B, et al. Oral contraceptives and breast cancer: a French case-control study. Int J Epidemiol. 1991;20:32-38.
47. Ewertz M. Oral contraceptives and breast cancer risk in Denmark. Eur J Cancer. 1992;28A:1176-1181.
48. Gomes AL, Guimaraes MD, Gomes CC, Chaves IG, Gobbi H, Camargos AF. A case-control study of risk factors for breast cancer in Brazil, 1978-1987. Int J Epidemiol. 1995;24:292-299.
49. Le MG, Bachelot A, Doyen F, Kramar A. Étude de la relation entre contraception orale et cancer du sein ou du col utérin : résultats préliminaires d'une enquête française. Contracept Fertil Sex (Paris). 1985 ; 13 : 553-558.
50. Lee NC, Rosero-Bixby L, Oberle MW, Grimaldo C, Whatley AS, Rovira EZ. A case-control study of breast cancer and hormonal contraception in Costa Rica. J Natl Cancer Inst. 1987;79:1247-1254.
51. Lee HP, Gourley L, Duffy SW, Esteve J, Lee J, Day NE. Risk factors for breast cancer by age and menopausal status: a case-control study in Singapore. Cancer Causes Control. 1992;3:313-322.
52. Marchbanks PA, McDonald JA, Wilson HG, et al. Oral contraceptives and the risk of breast cancer. N Engl J Med. 2002;346:2025-2032.
53. Marcus PM, Baird DD, Millikan RC, Moorman PG, Qaqish B, Newman B. Adolescent reproductive events and subsequent breast cancer risk. Am J Public Health. 1999;89:1244-1247.
54. Marubini E, Decarli A, Costa A, et al. The relationship of dietary intake and serum levels of retinol and beta-carotene with breast cancer: results of a case-control study. Cancer. 1988;61:173-180.
55. McCredie MR, Dite GS, Giles GG, Hopper JL. Breast cancer in Australian women under the age of 40. Cancer Causes Control. 1998;9:189-198.
56. McPherson K, Vessey MP, Neil A, Doll R, Jones L, Roberts M. Early oral contraceptive use and breast cancer: results of another case-control study. Br J Cancer. 1987;56:653-660.
57. Meirik O, Lund E, Adami HO, Bergstrom R, Christoffersen T, Bergsjo P. Oral contraceptive use and breast cancer in young women: a joint national case-control study in Sweden and Norway. Lancet. 1986;2:650-654.
58. Moorman PG, Millikan RC, Newman B. Oral contraceptives and breast cancer among African-American women and white women. J Natl Med Assoc. 2001;93:329-334.
59. Newcomb PA, Longnecker MP, Storer BE, et al. Recent oral contraceptive use and risk of breast cancer (United States). Cancer Causes Control. 1996; 7:525-532.
60. WHO Collaborative Study of Neoplasia and Steroid Contraceptives. Breast cancer and combined oral contraceptives: results from a multinational study. Br J Cancer. 1990;61:110-119.
61. Olsson H, Moller TR, Ranstam J. Early oral contraceptive use and breast cancer among premenopausal women: final report from a study in southern Sweden. J Natl Cancer Inst. 1989;81:1000-1004.
62. Palmer JR, Rosenberg L, Rao RS, et al. Oral contraceptive use and breast cancer risk among African-American women. Cancer Causes Control. 1995;6:321-331.
63. Paul C, Skegg DC, Spears GF. Oral contraceptives and risk of breast cancer. Int J Cancer. 1990;46:366-373.
64. Primic-Zakelj M, Evs.tifeeva T, Ravnihar B, Boyle P. Breast-cancer risk and oral contraceptive use in Slovenian women aged 25 to 54. Int J Cancer. 1995;62:414-420.
65. Rookus MA, van Leeuwen FE, Netherlands Oral Contraceptives and Breast Cancer Study Group. Oral contraceptives and risk of breast cancer in women aged 20-54 years. Lancet. 1994;344:844-851.
66. Rosenberg L, Palmer JR, Clarke EA, Shapiro S. A case-control study of the risk of breast cancer in relation to oral contraceptive use. Am J Epidemiol. 1992;136:1437-1444.
67. Shapiro S, Rosenberg L, Hoffman M, et al. Risk of breast cancer in relation to the use of injectable progestogen contraceptives and combined estrogen/progestogen contraceptives [une correction publiée apparaît en Am J Epidemiol. 2000;151:1134]. Am J Epidemiol. 2000;151:396-403.
68. Tessaro S, Beria JU, Tomasi E, Barros AJ. Oral contraceptives and breast cancer: a case-control study [en Portugais]. Rev Saude Publica. 2001 ; 35 : 32-38.
69. Traina A, Cusimano R, Liquori M, et al. Oral contraceptive use and breast cancer risk in areas with different incidence: a case-control study among young women. Ann N Y Acad Sci. 1996;784:564-569.
70. Ursin G, Wu AH, Hoover RN, et al. Breast cancer and oral contraceptive use in Asian-American women. Am J Epidemiol. 1999;150:561-567.
71. Weinstein AL, Mahoney MC, Nasca PC, Leske MC, Varma AO. Breast cancer risk and oral contraceptive use: results from a large case-control study. Epidemiology. 1991;2:353-358.
72. Wingo PA, Lee NC, Ory HW, Beral V, Peterson HB, Rhodes P. Agespecific differences in the relationship between oral contraceptive use and breast cancer. Cancer. 1993;71(suppl):1506-1517.
73. White E, Malone KE, Weiss NS, Daling JR. Breast cancer among young U.S. women in relation to oral contraceptive use. J Natl Cancer Inst. 1994; 86:505-514.
74. Yuan JM, Yu MC, Ross RK, Gao YT, Henderson BE. Risk factors for breast cancer in Chinese women in Shanghai. Cancer Res. 1988;48:1949-1953.
75. Rosenberg L, Palmer JR, Rao RS, et al. Case-control study of oral contraceptive use and risk of breast cancer. Am J Epidemiol. 1996;143:25-37.
76. The Centers for Disease Control Cancer and Steroid Hormone Study. Long-term oral contraceptive use and the risk of breast cancer. JAMA. 1983;249:1591-1595.
77. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development. Oral-contraceptive use and the risk of breast cancer. N Engl J Med. 1986;315:405-411.
78. Stadel BV, Lai SH, Schlesselman JJ, Murray P. Oral contraceptives and premenopausal breast cancer in nulliparous women. Contraception. 1988;38: 287-299.
79. Mayberry RM. Age-specific patterns of association between breast cancer and risk factors in black women, ages 20 to 39 and 40 to 54. Ann Epidemiol. 1994;4:205-213.
80. Miller DR, Rosenberg L, Kaufman DW, Stolley P, Warshauer ME, Shapiro S. Breast cancer before age 45 and oral contraceptive use: new findings. Am J Epidemiol. 1989;129:269-280.
81. Lund E, Meirik O, Adami HO, Bergstrom R, Christoffersen T, Bergsjo P. Oral contraceptive use and premenopausal breast cancer in Sweden and Norway: possible effects of different pattern of use. Int J Epidemiol. 1989;18:527-532.
82. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177-188.
83. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Lancet. 1996;347:1713-1727.
84. Althuis MD, Brogan DR, Coates RJ, et al. Hormonal content and potency of oral contraceptives and breast cancer risk among young women. Br J Cancer. 2003;88:50-57.
85. Nomura AM, Kolonel LN, Hirohata T, Lee J. The association of replacement estrogens with breast cancer. Int J Cancer. 1986;37:49-53.
86. McGregor H, Land CE, Choi K, et al. Breast cancer incidence among atomic bomb survivors, Hiroshima and Nagasaki, 1950-69. J Natl Cancer Inst. 1977;59:799-811.
87. Kirschstein RL, Rabson AS, Rusten GW. Infiltrating duct carcinoma of the mammary gland of a rhesus monkey after administration of an oral contraceptive: a preliminary report. J Natl Cancer Inst. 1972;48:551-556.
88. Geil RG, Lamar JK. FDA studies of estrogen, progestogens, and estrogen/progestogen combinations in the dog and monkey. J Toxicol Environ Health. 1977;3:179-193.
89. Shubik P. Oral contraceptives and breast cancer: laboratory evidence. IARC Sci Publ. 1985;(65):33-35.
90. Lanari C, Molinolo AA, Pasqualini CD. Induction of mammary adenocarcinomas by medroxyprogesterone acetate in BALB/c female mice. Cancer Lett. 1986;33:215-223.
91. Welsch CW, Adams C, Lambrecht LK, Hassett CC, Brooks CL. 17betaoestradiol and Enovid mammary tumorigenesis in C3H/HeJ female mice: counteraction by concurrent 2-bromo-alpha-ergocryptine. Br J Cancer. 1977;35:322-328.
92. Kahn RH, Baker BL. Effect of long-term treatment with norethynodrel on A-J and C3H-HeJ mice. Endocrinology. 1969;84:661-668.
93. Anderson TJ, Battersby S, King RJ, McPherson K, Going JJ. Oral contraceptive use influences resting breast proliferation. Hum Pathol. 1989;20:1139-1144.
94. Preston-Martin S, Pike MC, Ross RK, Jones PA, Henderson BE. Increased cell division as a cause of human cancer. Cancer Res. 1990;50:7415-7421.
95. Ames BN, Gold LS. Too many rodent carcinogens: mitogenesis increases mutagenesis. Science. 1990;249:970-971.
96. Cohen SM, Ellwein LB. Cell proliferation in carcinogenesis. Science. 1990;249:1007-1011.
97. Larimore WL, Stanford JB. Postfertilization effects of oral contraceptives and their relationship to informed consent. Arch Fam Med. 2000;9:126-133.
98. Norman RJ, McLoughlin JW, Borthwick GM, et al. Inhibin and relaxin concentrations in early singleton, multiple, and failing pregnancy: relationship to gonadotropin and steroid profiles. Fertil Steril. 1993;59:130-137.
99. Stewart DR, Overstreet JW, Nakajima ST, Lasley BL. Enhanced ovarian steroid secretion before implantation in early human pregnancy. J Clin Endocrinol Metab. 1993;76:1470-1476.
100. Another look at the pill and breast cancer. Lancet. 1985;2:985-987.
101. Hulka BS. Oral contraceptives: the good news. JAMA. 1983;249:1624-1625.
102. Olsson H, Borg A, Ferno M, Moller TR, Ranstam J. Early oral contraceptive use and premenopausal breast cancer: a review of studies performed in southern Sweden. Cancer Detect Prev. 1991;15:265-271.
103. Malone KE, Daling JR, Weiss NS. Oral contraceptives in relation to breast cancer. Epidemiol Rev. 1993;15:80-97.
104. Colton T, Greenberg ER, Noller K, et al. Breast cancer in mothers prescribed diethylstilbestrol in pregnancy: further follow-up. JAMA. 1993;269:2096-2100.
105. Olsson H, Ranstam J, Baldetorp B, et al. Proliferation and DNA ploidy in malignant breast tumors in relation to early oral contraceptive use and early abortions. Cancer. 1991;67:1285-1290.
106. Olsson H, Borg A, Ferno M, Ranstam J, Sigurdsson H. Her-2/neu and INT2 proto-oncogene amplification in malignant breast tumors in relation to reproductive factors and exposure to exogenous hormones. J Natl Cancer Inst. 1991;83:1483-1487.
107. Ranstam J, Olsson H, Garne JP, Aspegren K, Janzon L. Survival in breast cancer and age at start of oral contraceptive usage. Anticancer Res. 1991; 11:2043-2046.
108. Gammon MD, Hibshoosh H, Terry MB, et al. Oral contraceptive use and other risk factors in relation to HER-2/neu overexpression in breast cancer among young women. Cancer Epidemiol Biomarkers Prev. 1999;8:413-419.
109. Rosenberg MJ, Waugh MS. Oral contraceptive discontinuation: a prospective evaluation of frequency and reasons. Am J Obstet Gynecol. 1998;179: 577-582.
110. Potter LS. Oral contraceptive compliance and its role in the effectiveness of the method. In: Cramer JA, Spilker B, eds. Patient Compliance In Medical Practice and Clinical Trials. New York: Raven Press; 1991: 195-207.
111. Balassone ML. Risk of contraceptive discontinuation among adolescents. J Adolesc Health Care. 1989;10:527-533.
112. Nischan P, Ebeling K, Thomas DB, Hirsch U. Comparison of recalled and validated oral contraceptive histories. Am J Epidemiol. 1993;138:697-703.
113. Alexander FE, Roberts MM, Huggins A. Risk factors for breast cancer with applications to selection for the prevalence screen. J Epidemiol Community Health. 1987;41:101-106.
114. Beral V, Hermon C, Kay C, Hannaford P, Darby S, Reeves G. Mortality associated with oral contraceptive use: 25 year follow up of cohort of 46 000 women from Royal College of General Practitioners' oral contraception study. BMJ. 1999;318:96-100.
115. Calle EE, Martin LM, Thun MJ, Miracle HL, Heath CW Jr. Family history, age, and risk of fatal breast cancer. Am J Epidemiol. 1993;138:675-681.
116. Dumeaux V, Alsaker E, Lund E. Breast cancer and specific types of oral contraceptives: a large Norwegian cohort study. Int J Cancer. 2003;105:844-850.
117. Grabrick DM, Hartmann LC, Cerhan JR, et al. Risk of breast cancer with oral contraceptive use in women with a family history of breast cancer. JAMA. 2000;284:1791-1798.
118. Hankinson SE, Colditz GA, Manson JE, et al. A prospective study of oral contraceptive use and risk of breast cancer (Nurses' Health Study, United States). Cancer Causes Control. 1997;8:65-72.
119. Hiatt RA, Bawol R, Friedman GD, Hoover R. Exogenous estrogen and breast cancer after bilateral oophorectomy. Cancer. 1984;54:139-144.
120. Kay CR, Hannaford PC. Breast cancer and the pill: a further report from the Royal College of General Practitioners' oral contraception study. Br J Cancer. 1988;58:675-680.
121. Kumle M, Weiderpass E, Braaten T, Persson I, Adami HO, Lund E. Use of oral contraceptives and breast cancer risk: the Norwegian-Swedish Women's Lifestyle and Health Cohort Study. Cancer Epidemiol Biomarkers Prev. 2002;11:1375-1381.
122. Miller AB, Baines CJ, To T, Wall C. Canadian National Breast Screening Study: 1. Breast cancer detection and death rates among women aged 40 to 49 years [une correction publiée apparaît en CMAJ. 1993;148:718]. CMAJ. 1992;147: 1459-1476.
123. Mills PK, Beeson WL, Phillips RL, Fraser GE. Prospective study of exogenous hormone use and breast cancer in Seventh-day Adventists. Cancer. 1989;64:591-597.
124. Schuurman AG, van den Brandt PA, Goldbohm RA. Exogenous hormone use and the risk of postmenopausal breast cancer: results from The Netherlands Cohort Study. Cancer Causes Control. 1995;6:416-424.
125. Tomasson H, Tomasson K. Oral contraceptives and risk of breast cancer: a historical prospective case-control study. Acta Obstet Gynecol Scand. 1996;75:157-161.
126. Trapido EJ. A prospective cohort study of oral contraceptives and breast cancer. J Natl Cancer Inst. 1981;67:1011-1015.
127. Tryggvadottir L, Tulinius H, Gudmundsdottir GB. Oral contraceptive use at a young age and the risk of breast cancer: an Icelandic, population-based cohort study of the effect of birth year. Br J Cancer. 1997;75:139-143.
128. Van Hoften C, Burger H, Peeters PH, Grobbee DE, Van Noord PA, Leufkens HG. Long-term oral contraceptive use increases breast cancer risk in women over 55 years of age: the DOM cohort. Int J Cancer. 2000;87:591-594.
129. Vessey MP, McPherson K, Villard-Mackintosh L, Yeates D. Oral contraceptives and breast cancer: latest findings in a large cohort study. Br J Cancer. 1989;59:613-617.
130. Dickey RP, Stone SC. Progestational potency of oral contraceptives. Obstet Gynecol. 1976;47:106-112.
131. Staffa JA, Newschaffer CJ, Jones JK, Miller V. Progestins and breast cancer: an epidemiologic review. Fertil Steril. 1992;57:473-491.
132. Skegg DC, Noonan EA, Paul C, Spears GF, Meirik O, Thomas DB. Depot medroxyprogesterone acetate and breast cancer: a pooled analysis of the World Health Organization and New Zealand studies. JAMA. 1995;273:799-804.
133. Anderson GL, Limacher M, Assaf AR, et al, Women's Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA. 2004;291:1701-1712.
134. Tyrer L. Introduction of the pill and its impact. Contraception. 1999; 59 (suppl):11S-16S.