Uso de Anticonceptivos Orales como Factor de Riesgo de Cáncer de Mama Premenopáusico: Un Metaanálisis
Chris
Kahlenborn, MD; Francesmary Modugno, PHD, MPH; Douglas M. Potter, PhD;
et Walter B. Severs, PhD
|
Del Departamento de Medicina Interna, Hospital Altoona, Altoona, Pa
(C.K.), Departamento de Epidemiología (F.M.) y
Departamento de Bioestadística (D.M.P.), Universidad de
Pittsburg e Instituto del Cáncer de la Universidad de Pittsburg,
Pittsburg, Pa; y Departamento de Farmacología, Universidad del
Estado de Pensilvania, Hershey (W.B.S.). |
Resumen
Comienzo del articulo
MÉTODOS
BÚSQUEDA BIBLIOGRÁFICA, FUENTES DE DATOS Y SELECCIÓN DE ESTUDIOSRESULTADOS
RECOLECCIÓN DE DATOS
ANÁLISIS ESTADÍSTICO
DISCUSIÓN
CONCLUSIÓN
REFERENCIAS
♦OBJETIVO: Lllevar a cabo un metaanálisis de estudios de casos y controles orientados a elucidar si el uso previo de anticonceptivos orales (AO) está asociado al cáncer de mama premenopáusico.
METODOS: Investigamos las bases de datos Medline y PubMed y efectuamos revisiones bibliográficas a fin de identificar estudios de casos y controles sobre anticonceptivos orales y cáncer de mama premenopáusico, publicados a partir de 1980 inclusive. Entre los términos de búsqueda incluimos neoplasmas de mama, anticonceptivos orales, agentes anticonceptivos, y estudios de casos y controles. Incluimos estudios redactados en todos los idiomas. Identificamos 34 estudios que satisfacían los criterios de inclusión. Dos investigadores extrajeron datos de artículos originales de investigación u obtuvieron datos adicionales provistos por los autores de los estudios. Utilizamos el método de DerSimonian-Laird para calcular las razones de posibilidades agrupadas (RP) y los intervalos de confianza (IC), y la prueba de Mantel-Haenszel para investigar la asociación entre el uso de AO y el cáncer.
RESULTADOS: El uso de AO estuvo asociado a un aumento del riesgo de cáncer de mama premenopáusico en general (RP, 1,19; 95% IC, 1,09-1,29) y para varios patrones de uso de AO. Entre los estudios que suministraron datos relativos a mujeres nulíparas y uníparas/ multíparas en forma separada, el uso de AO resultó asociado al riesgo de cáncer de mama tanto en mujeres uníparas/ multíparas (RP, 1,29; 95% IC, 1,20-1,40) como nulíparas (RP, 1,24; 95% IC, 0,92-1,67). Un uso más prolongado no modificó sustancialmente el riesgo en mujeres nulíparas (RP, 1,29; 95% IC, 0,85-1,96). Entre las mujeres uníparas/ multíparas, la asociación fue más evidente cuando los AO se utilizaron antes del primer embarazo a término (PET) (RP, 1,44, 95% IC, 1,28-1,62) que cuando se lo hizo después del mismo (RP, 1,15; 95% CI, 1,06-1,26). La mayor asociación entre el uso de AO y el riesgo de cáncer de mama se registró en las mujeres uníparas/ multíparas que habían utilizado AO durante 4 años o más antes del PET (RP, 1,52; 95% IC, 1,26-1,82).
CONCLUSION: El uso de AO está asociado a un aumento del riesgo de cáncer de mama premenopáusico, especialmente cuando estos fármacos son tomados por mujeres uníparas/ multíparas antes del PET.
Mayo Clin Proc. 2006 ; 81(10) : 1290-1302
IC = intervalo de confianza; PET = primer embarazo a término; AO = anticonceptivos orales; RP = razón de posibilidad
♦El cáncer de mama es el principal tipo de cáncer en mujeres en todo el mundo y la causa más común de mortalidad por cáncer entre las mujeres norteamericanas de 20 a 59 años.1 Cada año en Estados Unidos, aproximadamente 211.000 mujeres desarrollan cáncer de mama y más de 47.000 (20%), antes de cumplir 50 años.2 Se prevé que alrededor de 2 de cada 15 mujeres norteamericanas sufrirán cáncer de mama a lo largo de su vida, y que casi 40.000 mujeres morirán a causa de esta enfermedad por año.2. A lo largo de las últimas cuatro décadas, la incidencia del cáncer de mama ha ido aumentado permanentemente en todo el mundo, y este aumento ha sido mayor en los países industrializados, sobre todo entre las mujeres más jóvenes. Por ejemplo, de 1973 a 1999, la incidencia del cáncer de mama en Estados Unidos aumentó un 9,8% entre las mujeres blancas de menos de 50 años (la tasa varió de 39,8 a 43,7 por 100.000 habitantes) y un 26,4% entre las mujeres afroamericanas de menos de 50 años (la tasa pasó de 34,8 a 44,0 por 100.000 habitantes).3
Si bien la comunidad médica ha admitido desde hace tiempo la existencia de factores de riesgo de cáncer de mama tales como los antecedentes familiares, la menarquia temprana, la menopausia tardía, la nuliparidad y la falta de amamantamiento4,7, persiste la discrepancia respecto del potencial carcinogénico de las hormonas femeninas. El ensayo clínico de la Women's Health Initiative señaló que la exposición prolongada a estrógenos y progestinas exógenos en la terapia hormonal aumenta la posibilidad de desarrollar cáncer de mama en la mujer.8 Además, la Organización Mundial de la Salud clasificó recientemente tanto a la terapia de reemplazo hormonal posmenopáusica como a los anticonceptivos orales (AO) como carcinógenos del grupo 1.9
La vinculación entre los AO y el riesgo posterior de cáncer de mama ha variado en la literatura médica a lo largo del tiempo. Sólo uno de cada quince estudios llevados a cabo antes de 1980 mostró una asociación positiva.10 Sin embargo, estudios más recientes han puesto en evidencia un incremento del riesgo entre quienes utilizan AO, especialmente entre las mujeres que los tomaban antes de un primer embarazo a término (PET).10-15 La diferencia con respecto a los hallazgos más recientes puede deberse al patrón cambiante en el uso de AO: las mujeres que tomaron AO entre fines de los años 70 y la década del 90 fueron más propensas a utilizarlos antes del PET y durante mayores períodos de tiempo que las mujeres que los emplearon en los años 60 y a comienzos de los 70.11. Las mujeres expuestas a agentes carcinógenos antes del PET pueden tener un riesgo mayor de desarrollar cáncer de mama, dado que el tejido glandular mamario no ha sufrido aún la diferenciación ulterior inducida por el embarazo.16 La diferenciación de la glándula mamaria durante la gestación inhibe el inicio de la carcinogénesis16 y puede explicar la protección natural conferida por el embarazo.17,18
Emprendimos un metaanálisis de estudios de casos y controles realizados a partir de 1980, a fin de aclarar la relación posible entre el uso de AO y el riesgo de cáncer de mama en mujeres premenopáusicas o en mujeres de menos de 50 años. En los análisis aquí presentados, asumimos que la mayor parte de las mujeres de menos de 50 años eran premenopáusicas. Limitamos nuestro análisis a estudios en los que la mayor parte de las mujeres desarrolló cáncer de mama en 1980 o más tarde, de modo de contar con un adecuado período de latencia entre el uso de AO y el diagnóstico de cáncer de mama. Incluso limitamos nuestro análisis a las mujeres premenopáusicas, ya que la mayor parte de las posmenopáusicas incluidas en los estudios de los 80 y los 90 no tuvieron una gran exposición a los AO antes del primer embarazo a término (PET). Por lo tanto, es difícil evaluar las relaciones entre el uso de AO, el embarazo y el cáncer de mama posmenopáusico.
MÉTODOS:
BÚSQUEDA BIBLIOGRÁFICA, FUENTES DE DATOS Y SELECCIÓN DE ESTUDIOS
Investigamos las bases de datos Medline y PubMed a fin de identificar estudios de casos y controles sobre cáncer de mama y uso de anticonceptivos orales, publicados a partir de 1980. Entre los términos de búsqueda se incluyeron neoplasia mamaria, anticonceptivos orales, agentes anticonceptivos, y estudios de casos y controles. Encontramos más estudios al revisar las bibliografías de los estudios identificados y de metaanálisis previos.10-15
Sólo se incluyeron en nuestro análisis los estudios en que los casos y los controles eran mujeres premenopáusicas o menores de 50 años y en los que la mayor parte de los casos desarrollaron cáncer de mama durante o después de 1980. Se identificó un total de 60 estudios potencialmente elegibles. Veintiséis de ellos se excluyeron por varias razones: 8 estudios se basaban en datos previos a 1980,19-25 2 estudios (identificados en el estudio de Oxford11) nunca se publicaron, 1 estudio examinó exclusivamente el uso de hormonas con fines no anticonceptivos,26 1 estudio se centró en mujeres de 50 años o más27 y 2 estudios28,29 habían sido integrados en un estudio más reciente, que se incluyó. 30 Un estudio se excluyó porque la mayor parte de las mujeres habían usado AO durante 6 meses o menos antes del PET31; 11 estudios se excluyeron porque no logramos obtener datos específicos sobre mujeres premenopáusicas o mujeres de menos de 50 años.32-42 Esto dio como resultado un total de 34 estudios elegibles.30,43-75 Cuatro estudios66,67,72,75 informaron sus datos en dos grupos de edad separados. Wingo et al,72 Shapiro et al,67 y Rosemberg et al75 informaron sus datos por franjas etarias de menos de 35 años y de 35 a 44 años. Rosemberg et al66 informaron sus datos por categorías de edad de menos de 40 años y de 40 a 49 años. Es decir que en estos estudios las mujeres se clasificaron según la edad a la que se diagnosticaba su condición (casos) o a la que se incorporaban al estudio (controles). Un estudio utilizó controles de población hospitalaria o de población general, dependiendo del lugar. Se consideraron como estudios independientes.68 De este modo, hubo un total de 39 estudios independientes para analizar, enumerados en la tabla 130,43-74. De estos 39 estudios, dos54,74 no proporcionaron datos sobre antecedentes de uso o ausencia de uso previo de AO en todas las mujeres pero proveyeron datos para ciertas categorías de análisis por subgrupos (antecedentes de uso o ausencia de uso previo en mujeres uníparas/ multíparas, uso en mujeres uníparas/ multíparas antes y después del PET) y, por lo tanto, se incluyen en algunos de los análisis presentados aquí.
Buscamos contactar a los autores de los estudios si faltaban datos sobre uso de AO antes del primer embarazo a término (PET). Varios de ellos nos suministraron estos datos.48,55,61,64,65,71,73,74 No analizamos el subgrupo de mujeres que tomaron AO antes del (PET) en aquellos estudios en los que la mayor parte de las mujeres utilizaron AO durante menos de 6 meses (PET).31,44 Evitamos duplicar el ingreso de los datos hallados en múltiples informes; en estos casos, se utilizó la forma más reciente o abarcativa del estudio. Como ejemplo, se pueden mencionar tres estudios norteamericanos4,59,72,75-80, un estudio sueco57,81 y un estudio italiano.28-30
RECOLECCIÓN DE DATOS
Todos los datos fueron obtenidos por dos personas en forma independiente (C.K. y un asistente de investigación) y se ingresaron en una planilla Excel (Microsoft Inc., Redmond, Wash.). El proceso de recolección incluyó información descriptiva sobre el diseño del estudio y el detalle de las mediciones de la exposición y de los resultados. La información descriptiva incluyó el autor, el año de publicación e idioma, el lugar del estudio, el período de reclutamiento, el tipo de diseño (población hospitalaria o población general), las tasas de participación y el tipo de entrevista. Las mediciones de exposición incluyeron los antecedentes de uso de AO, los antecedentes de uso de AO por parte de mujeres uníparas/ multíparas, los antecedentes de uso de AO por parte de mujeres uníparas/ multíparas antes y después del PET, el uso de AO durante 4 años o más antes del PET por parte de mujeres uníparas/multíparas, los antecedentes de uso de AO por parte de mujeres nulíparas y el uso de AO por parte de mujeres nulíparas durante 4 años o más. Todos los datos obtenidos fueron revisados por una tercera persona (F.M.) y las inconsistencias se resolvieron en forma conjunta.
ANÁLISIS ESTADÍSTICO
Este metaanálisis utilizó el modelo de efectos aleatorios DerSimonian-Laird82 para calcular las razones de posibilidades combinadas (RP), los intervalos de confianza de 95% (ICs) y los valores p para la hipótesis nula de no vinculación entre el uso de AO y el cáncer. Las RP individuales y sus varianzas se calcularon a partir del número bruto de casos y controles publicado para cada estudio. La homogeneidad de las RP se investigó de la manera estándar, utilizando el estadístico Q (ver, por ejemplo, DerSimonian y Laird82).
En el caso de los análisis relativos al subgrupo de mujeres uníparas/ multíparas que utilizaron AO antes del PET, la mayor parte de los estudios definieron como “no usuarias” a las mujeres que nunca habían tomado AO. Sin embargo, un estudio58 definió como “no usuarias” de AO a las mujeres que no habían tomado AO antes del PET (pero que podrían haberlo hecho más adelante). Dos estudios43,75 definieron como “no usuarias” a las mujeres cuyo uso de AO no había superado los 6 y 12 meses, respectivamente. Los análisis se llevaron a cabo incluyendo y excluyendo estos 3 estudios, sin hallarse diferencias en los resultados.
|
TABLA 1. Estudios sobre Uso de Anticonceptivos Orales y Riesgo de Cáncer de Mama en Mujeres
*G = población general; H = población hospitalaria; OMS = Organización Mundial de la Salud |
RESULTADOS:
De los 34 estudios identificados para la inclusión en este análisis, 14 se basaban en una población hospitalaria, 19 tomaban a la población general, y 1 estaba formado por una combinación de controles de población hospitalaria y población general. Los estudios provenían de diferentes países: Australia (1),55; Brazil(2),48,68 Canadá (1),66 China (1),74 Costa Rica (1),50 Dinamarca (1),47 Inglaterra (2),45,56 Francia (2),46,49 Italia (3),30,54,69 Nueva Zelanda (1),63 Singapur (1),51 Eslovenia (1),64 Sudáfrica (1),67 Suecia (2),57,61 Taiwán (1),44 Países Bajos (1),65 y Estados Unidos (11).42,43,52,53,58,59,62,71-73,75 Un estudio analizó datos multinacionales.60
En general, el uso de AO se reveló vinculado a un incremento del riesgo de cáncer de mama (Figura 1), con una razón de posibilidades agrupadas de 1,19 (95% IC, 1,09-1,29). De los 39 estudios señalados en la Tabla 1, dos estudios54,74 no incluyeron datos sobre antecedentes de uso o no de AO y, por lo tanto, no se incluyeron en el análisis de la Figura 1. De los 37 estudios restantes, 29 tenía RP mayores de 1 y 8 tenían RP menores de 1. Nueve estudios informaron valores p < 0,05 (que variaban entre 5 x 10-8 y 0,031) para la hipótesis nula de no vinculación entre uso de AO y cáncer; de estos 9 estudios, sólo 1 tenía una RP de menos de 1. En el análisis agrupado, el valor p de no vinculación entre uso de AO y cáncer fue de 9,5 x 10-5. Cabe destacar que el valor p para la homogeneidad entre los estudios fue de 2,0 x 10–6; esto muestra claras diferencias entre los estudios. Aunque la presencia de heterogeneidad es clara, la fuente de la misma no puedelocalizarse ni inferirse a partir de informes individuales. Es probable que se deba a la variabilidad genética de las poblaciones individuales de cada estudio, así como a diversos factores culturales y ambientales.
|
Casos/Controles |
|||||
| Referencia | Usuarias de AO |
No usuarias de AO |
RP (95% IC) | Valor P | |
| Todas | 1,19 (1,09-1,29) | 9,5 x 10–5 | 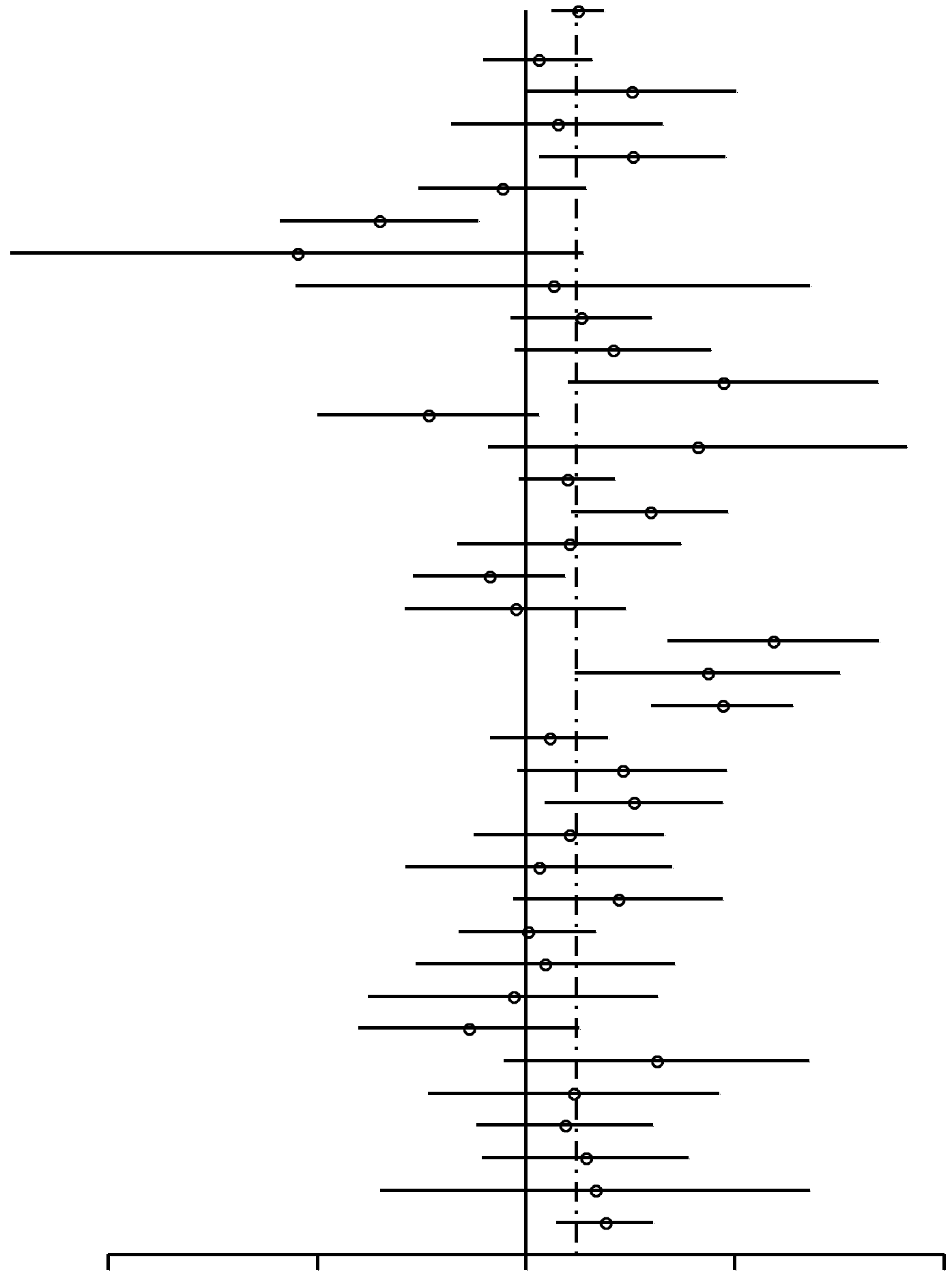 |
||
| Wingo,72 1993* | 117/976 | 328/298 | 1,04 (0,87-1,24) | 0,70 | |
| Wingo,72 1993† | 432/556 | 57/104 | 1,42 (1-2) | 0,058 | |
| White,73 1994 | 689/879 | 58/82 | 1,11 (0,78-1,57) | 0,63 | |
| Weinstein,71 1991 | 175/145 | 151/178 | 1,42 (1,04-1,94) | 0,031 | |
| Ursin,70 1999 | 618/626 | 124/116 | 0,92 (0,7-1,22) | 0,62 | |
| Traina,69 1996 | 103/138 | 197/162 | 0,61 (0,44-0,85) | 0,0047 | |
| Tessaro,68 2001‡ | 40/139 | 8/13 | 0,47 (0,18-1,21) | 0,19 | |
| Tessaro,68 2001§ | 44/146 | 8/29 | 1,09 (0,47-2,56) | 0,99 | |
| Tavani,30 1999 | 221/227 | 358/441 | 1,2 (0,95-1,51) | 0,14 | |
| Shapiro,67 2000* | 91/274 | 98/393 | 1,33 (0,96-1,84) | 0,099 | |
| Shapiro,67 2000† | 36/140 | 34/254 | 1,92 (1,15-3,21) | 0,017 | |
| Rosenberg,66 1992* | 98/225 | 79/131 | 0,72 (0,5-1,04) | 0,099 | |
| Rosenberg,66 1992† | 66/118 | 13/41 | 1,76 (0,88-3,53) | 0,15 | |
| Rosenberg,75 1996* | 455/606 | 617/940 | 1,14 (0,98-1,34) | 0,10 | |
| Rosenberg,75 1996† | 184/421 | 134/462 | 1,51 (1,16-1,95) | 0,0023 | |
| Rookus,65 1994 | 613/605 | 58/66 | 1,15 (0,8-1,67) | 0,51 | |
| Primic-Zakelj,64 1995 | 250/249 | 251/221 | 0,88 (0,69-1,14) | 0,37 | |
| Paul,63 1990 | 345/1081 | 43/130 | 0,96 (0,67-1,39) | 0,92 | |
| Palmer,62 1995 | 119/222 | 65/275 | 2,27 (1,6-3,22) | 5,4 x 10–6 | |
| Olsson,61 1989 | 143/329 | 31/130 | 1,82 (1,18-2,82) | 0,0092 | |
| Estudio OMS,60 1990 | 160/1613 | 141/2722 | 1,91 (1,51-2,42) | 5,2 x 10–8 | |
| Newcomb,59 1996 | 862/1555 | 188/366 | 1,08 (0,89-1,31) | 0,47 | |
| Moorman,58 2001 | 428/328 | 75/79 | 1,37 (0,97-1,94) | 0,087 | |
| Meirik,57 1986 | 326/371 | 96/156 | 1,43 (1,06-1,92) | 0,021 | |
| McPherson,56 1987 | 240/229 | 111/122 | 1,15 (0,84-1,58) | 0,42 | |
| McCredie,55 1998 | 418/366 | 46/42 | 1,04 (0,67-1,62) | 0,94 | |
| Marcus,53 1999 | 428/328 | 76/79 | 1,36 (0,96-1,92) | 0,10 | |
| Marchbanks,52 2002 | 1264/1305 | 165/171 | 1,0 (0,8-1,26) | 0,98 | |
| Lee,50 1987 | 50/302 | 47/302 | 1,06 (0,69-1,63) | 0,86 | |
| Lee,51 1992 | 41/80 | 68/127 | 0,96 (0,59-1,54) | 0,95 | |
| Le,49 1985 | 161/217 | 79/88 | 0,83 (0,57-1,19) | 0,35 | |
| Gomes,48 1995 | 35/60 | 64/169 | 1,54 (0,93-2,56) | 0,12 | |
| Ewertz,47 1992 | 165/167 | 38/45 | 1,17 (0,72-1,9) | 0,61 | |
| Clavel,46 1991 | 204/204 | 154/175 | 1,14 (0,85-1,52) | 0,43 | |
| UK National45 1989 | 688/675 | 67/80 | 1,22 (0,86-1,71) | 0,30 | |
| Chie,44 1998 | 13/26 | 84/211 | 1,26 (0,62-2,56) | 0,66 | |
| Brinton,43 1995 | 1259/1074 | 389/431 | 1,3 (1,11-1,52) | 0,0015 | |
| 0,250,51,02,04,0 | |||||
|
FIGURA
1. Resumen de estimaciones de riesgo de cáncer de mama en
mujeres premenopáusicas y en mujeres de menos de 50
años asociado al antecedente de uso de anticonceptivos
orales (AO) Entre los 39 estudios elegibles enumerados en la Tabla 1,
treinta y siete aportaron datos sobre antecedentes de uso o no de AO.
Incluye estudios de casos y controles en mujeres
premenopáusicas (o de menos de 50 años) tanto
uníparas/ multíparas como nulíparas
que utilizaron AO alguna vez comparadas con mujeres que no los
utilizaron. En cada estudio, la mayor parte de las pacientes
desarrollaron cáncer de mama después de 1980. |
|||||
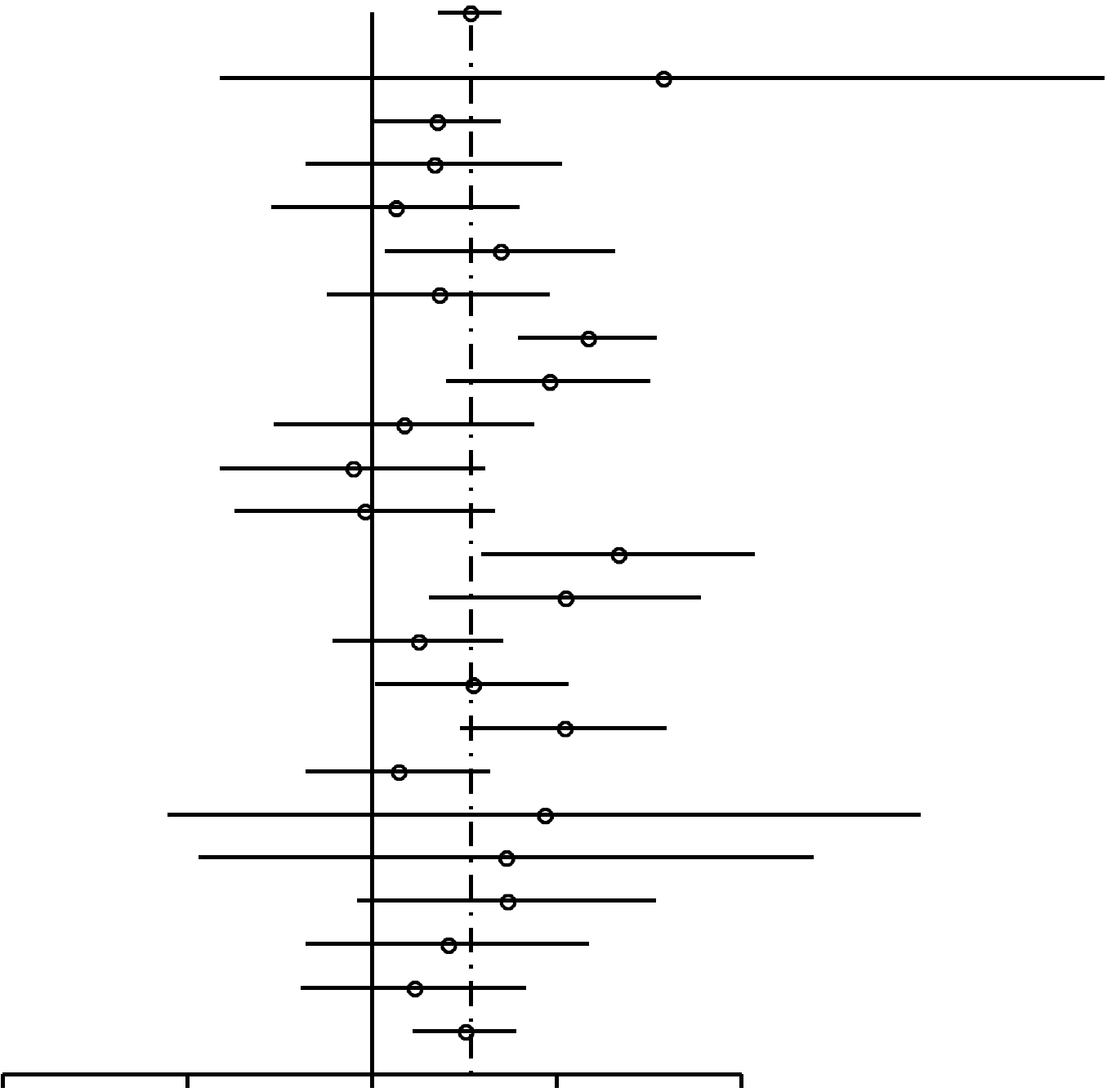
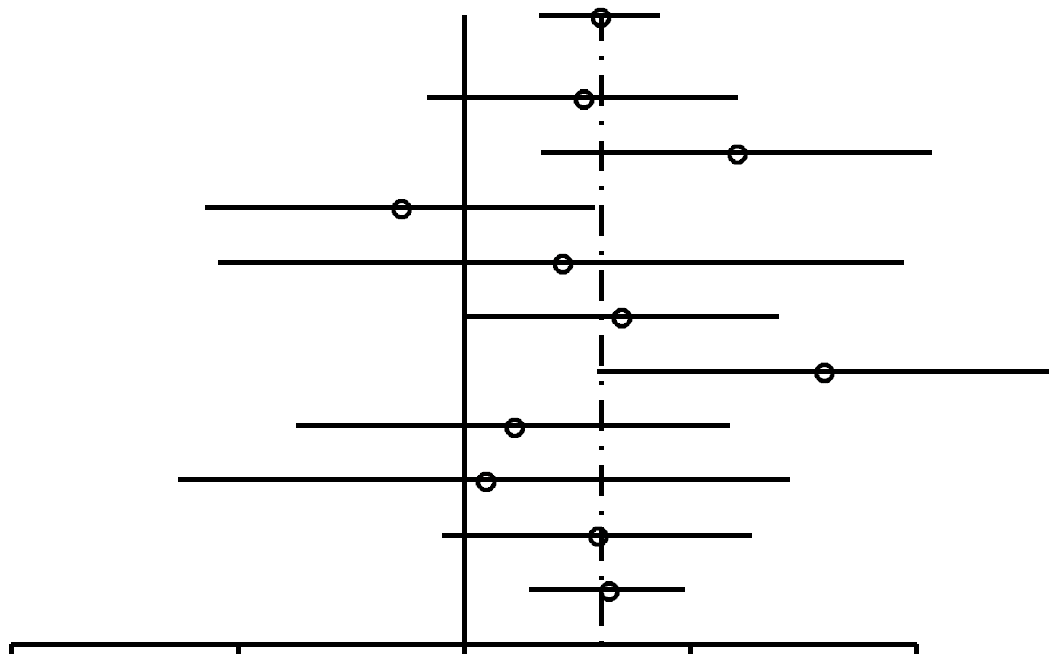
Como se muestra en la Figura 2, las RP para las mujeres nulíparas que utilizaron ocasionalmente AO (RP, 1,24; 95% IC, 0,92-1,67) resultaron similares a las de las mujeres nulíparas que utilizaron AO durante 4 años o más (RP, 1,29; 95% IC, 0,85-1,96). En las mujeres uníparas/ multíparas (Figuras 3 y 4), la asociación entre uso de AO y riesgo de cáncer de mama con respecto a mujeres que habían utilizado ocasionalmente AO fue de 1,29 (95% IC, 1,20-1,40). El riesgo de cáncer de mama asociado al uso de AO antes del PET (RP, 1,44; 95% IC, 1,28-1,62; 99% IC, 1,24-1,68) resultó superior al evidenciado cuando los AO se usaban después del PET (RP, 1,15; 95% IC, 1,06-1,26). La mayor asociación entre uso de AO y riesgo de cáncer de mama se registró en las mujeres uníparas/ multíparas que tomaron AO durante 4 años o más antes del PET (RP, 1,52; 95% IC, 1,26-1,82; 99% IC, 1,19-1,93).
|
Casos/Controles |
|||||
| Referencia | Usuarias de AO |
No usuarias de AO |
RP (95% IC) | Valor P | |
| Todas | 1,24 (0,92-1,67) | 0,17 | 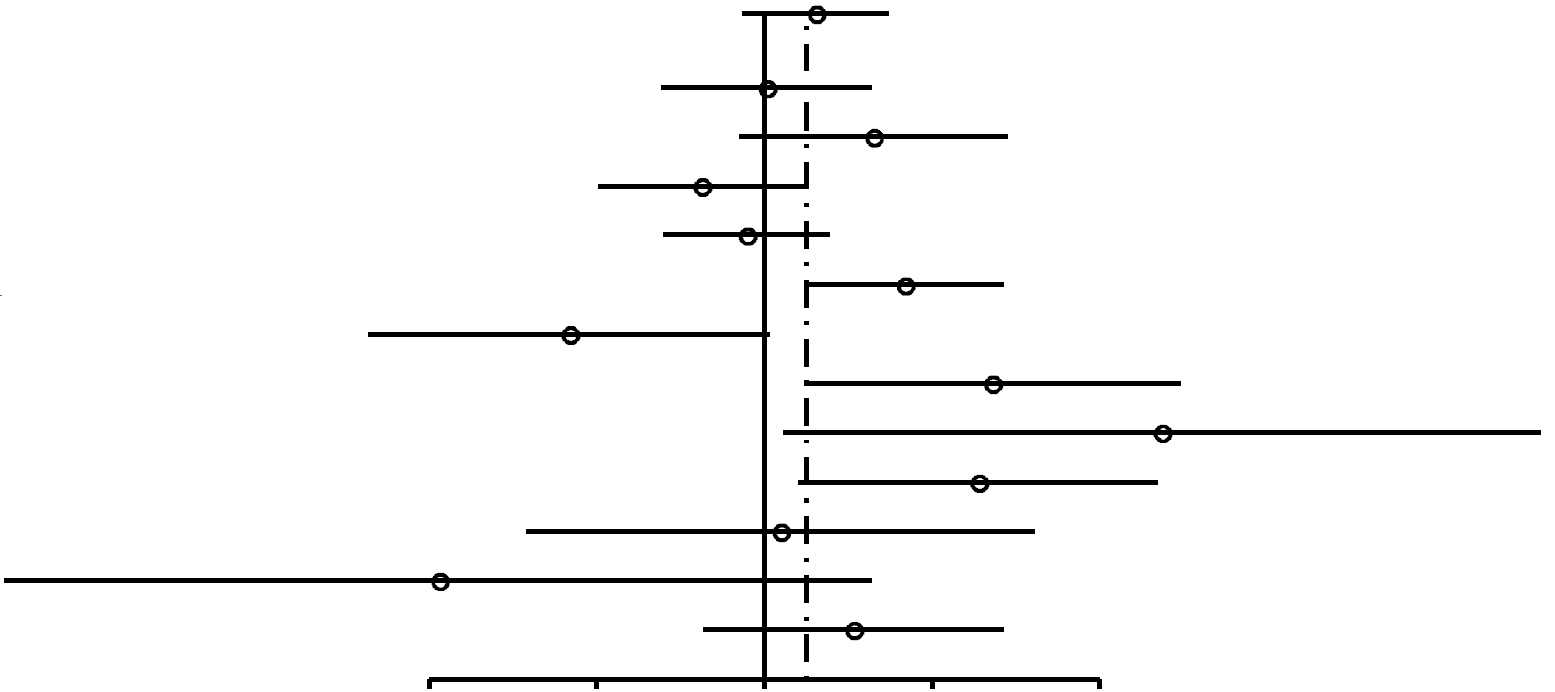 |
||
| Wingo,72 1993* | 147/96 | 79/52 | 1,01 (0,65-1,56) | 0,94 | |
| Wingo,72 1993† | 107/161 | 22/52 | 1,57 (0,9-2,74) | 0,14 | |
| Ursin,70 1999 | 216/227 | 58/47 | 0,77 (0,5-1,18) | 0,28 | |
| Rosenberg,75 1996* | 99/122 | 153/175 | 0,93 (0,66-1,31) | 0,73 | |
| Rosenberg,75 1996† | 74/173 | 51/213 | 1,79 (1,19-2,69) | 0,0071 | |
| Paul,63 1990 | 26/127 | 11/24 | 0,45 (0,2-1,02) | 0,09 | |
| Palmer,62 1995 | 20/23 | 21/62 | 2,57 (1,18-5,58) | 0,028 | |
| Olsson,61 1989 | 18/33 | 2/19 | 5,18 (1,08-24,81) | 0,055 | |
| Meirik,57 1986 | 44/40 | 15/33 | 2,42 (1,15-5,1) | 0,031 | |
| McPherson,56 1987 | 26/27 | 9/10 | 1,07 (0,38-3,06) | 0,89 | |
| Ewertz,47 1992 | 10/11 | 7/2 | 0,26 (0,04-1,56) | 0,27 | |
| UK National,45 1989 | 138/113 | 22/26 | 1,44 (0,78-2,68) | 0,32 | |
|
Casos/Controles |
0,250,51,02,04,0 | ||||
| Referencia | Usuarias de AO |
No usuarias de AO |
RP (95% IC) | Valor P | |
| Todas | 1,29 (0,85-1,96) | 0,24 | 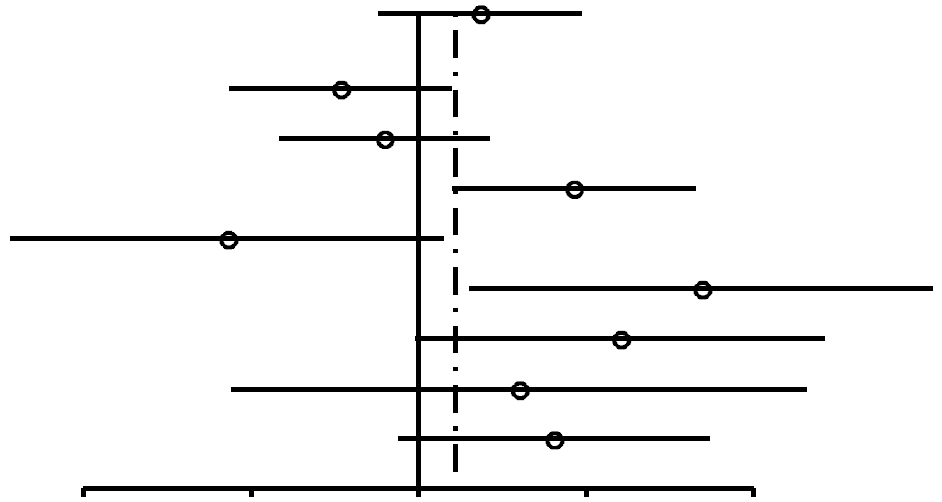 |
||
| Ursin,70 1999 | 117/131 | 58/47 | 0,72 (0,46-1,14) | 0,21 | |
| Rosenberg,75 1996* | 47/62 | 153/175 | 0,87 (0,56-1,34) | 0,60 | |
| Rosenberg,75 1996† | 35/77 | 51/213 | 1,9 (1,15-3,14) | 0,017 | |
| Paul,63 1990 | 16/77 | 11/24 | 0,45 (0,18-1,11) | 0,13 | |
| Palmer,62 1995 | 12/11 | 21/62 | 3,22 (1,24-8,38) | 0,028 | |
| Meirik,57 1986 | 23/22 | 15/33 | 2,3 (0,99-5,36) | 0,084 | |
| McPherson,56 1987 | 15/11 | 9/10 | 1,52 (0,46-4,98) | 0,70 | |
| UK National,45 1989 | 105/71 | 22/26 | 1,75 (0,92-3,32) | 0,12 | |
| 0,250,51,02,04,0 | |||||
|
FIGURA
2. Resumen de estimaciones de riesgo de cáncer de mama en mujeres nulíparas premenopáusicas y en mujeres de
menos de 50 años asociado a antecedentes de uso de anticonceptivos orales (AO) |
|||||
DISCUSIÓN
Los resultados de este metaanálisis sugieren que el uso de AO está asociado a un aumento del riesgo de cáncer de mama en las mujeres premenopáusicas o en las mujeres de menos de 50 años. El mayor riesgo parece darse en mujeres uníparas/ multíparas que utilizan AO antes del PET.
Nuestros resultados concuerdan con metaanálisis anteriores y con análisis agrupados de estudios realizados sobre todo en los años 70 y 80. Thomas12 señaló un incremento del 40% en el riesgo de cáncer de mama (RP, 1,4; 95% IC, 1,2-1,7) en mujeres premenopáusicas y posmenopáusicas que habían usado AO antes del PET. Los estudios sobre mujeres que tuvieron una elevada exposición a los AO a una edad temprana (mujeres premenopáusicas o mujeres de menos de 50 años) mostraron también riesgos elevados. Rushton y Jones15 observaron que las mujeres de menos de 45 años que usaban AO no presentaban un mayor riesgo si se analizaban estudios realizados antes de 1982 (RP, 0,90; 95% IC, 0,77-1,05). Sin embargo, al analizar estudios realizados después de 1982, se observó un riesgo bajo pero significativo (RP, 1,25; 95% IC, 1,15-1,36). Delgado-Rodríguez et al14 analizaron estudios realizados entre 1966 y 1990 e informaron una RP de 1,60 (95% IC, 1,14-2,24) para las mujeres premenopáusicas que usaron AO durante 96 meses o más antes del PET. Romieu et al10 comprobaron que las mujeres de menos de 46 años que habían usado AO durante 4 años o más antes del PET experimentaban un aumento significativo del riesgo de 72% (RP, 1,72; 95% IC, 1,36-2,19).
Nuestros resultados difieren en cierto modo de los obtenidos en el análisis agrupado de Oxford.83 Ante todo, el estudio de Oxford concluyó que las mujeres cuyo consumo de AO comenzó antes de los 20 años de edad tenían un riesgo relativo más elevado que aquéllas que comenzaron a utilizarlos después de los 20 años. Estos hallazgos parecen apoyar nuestros resultados en cuanto al aumento del riesgo con el uso de AO antes del PET en mujeres uníparas/ multíparas, dado que muchas mujeres que tomaron AO antes de los 20 años lo hicieron probablemente antes del PET. Además, el estudio de Oxford mostró que las mujeres uníparas/ multíparas que usaban AO dentro de los 4 años previos a su participación en el estudio, y antes del PET, presentaban un aumento significativo de riesgo (riesgo relativo, 1,30 para uso actual y 1,36 para un último uso de 1 a 4 años antes).83
|
Casos/Controles |
|||||
| Referencia | Usuarias de AO | No usuarias de AO | RP (95% IC) | Valor P | |
| Todas | 1,29 (1,2-1,4) | 8,4x 10–11 |
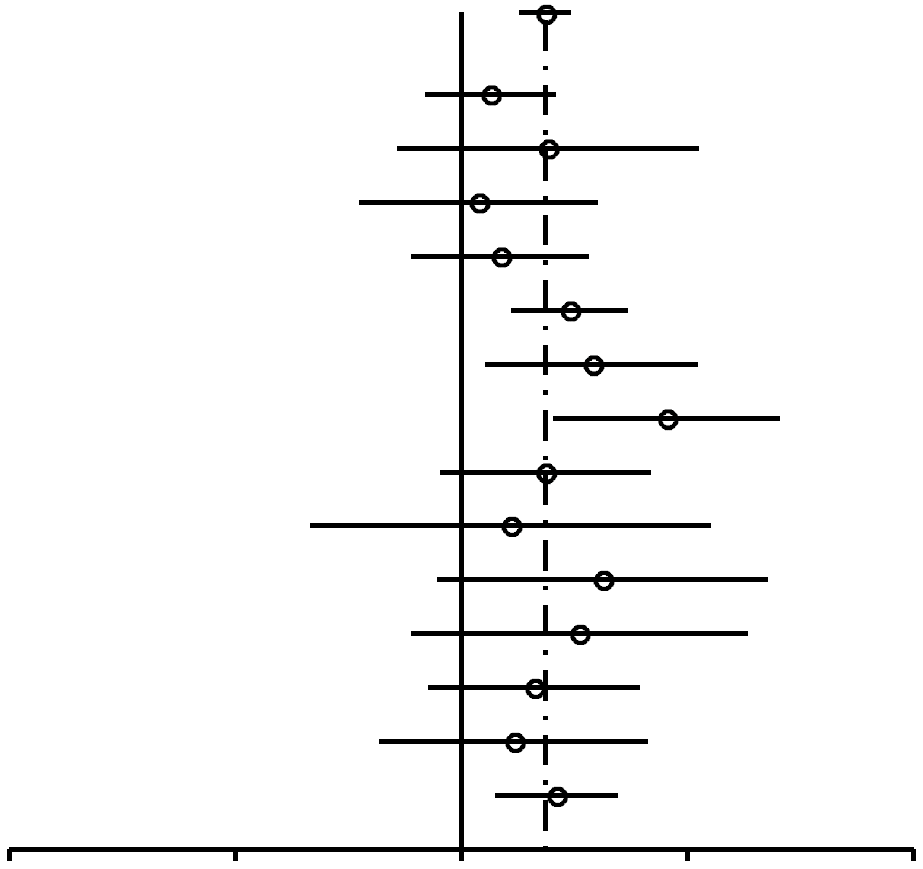 |
||
| Wingo,721993* | 949/858 | 249/246 | 1,09 (0,9-1,33) | 0,41 | |
| Wingo,721993† | 317/383 | 33/52 | 1,3 (0,82-2,07) | 0,31 | |
| Ursin,701999 | 402/399 | 66/69 | 1,05 (0,73-1,52) | 0,85 | |
| Tavani,301999 | 176/163 | 273/285 | 1,13 (0,86-1,48) | 0,42 | |
| Rosenberg,751996* | 389/460 | 464/765 | 1,39 (1,17-1,66) | 0,00029 | |
| Rosenberg,751996† | 132/265 | 83/249 | 1,49 (1,08-2,07) | 0,019 | |
| Palmer,621995 | 99/199 | 79/298 | 1,88 (1,33-2,65) | 0,00046 | |
| Meirik,571986 | 282/331 | 81/123 | 1,29 (0,94-1,79) | 0,14 | |
| Marubini,541988 | 66/72 | 26/33 | 1,16 (0,63-2,15) | 0,74 | |
| Gomes,481995 | 35/60 | 64/169 | 1,54 (0,93-2,56) | 0,12 | |
| Ewertz,471992 | 154/149 | 31/43 | 1,43 (0,86-2,4) | 0,21 | |
| Clavel,461991 | 185/175 | 115/136 | 1,25 (0,9-1,73) | 0,20 | |
| UK National,45 1989 | 550/562 | 45/54 | 1,17 (0,78-1,77) | 0,51 | |
| Brinton,431995 | 965/848 | 274/322 | 1,34 (1,11-1,61) | 0,0025 | |
|
Casos/Controles |
0,250,51,02,04,0 | ||||
| Referencia | Usuarias de AO | No usuarias de AO | RP (95% IC) | Valor P | |
| Todas | 1,15 (1,06-1,26) | 0,0015 |
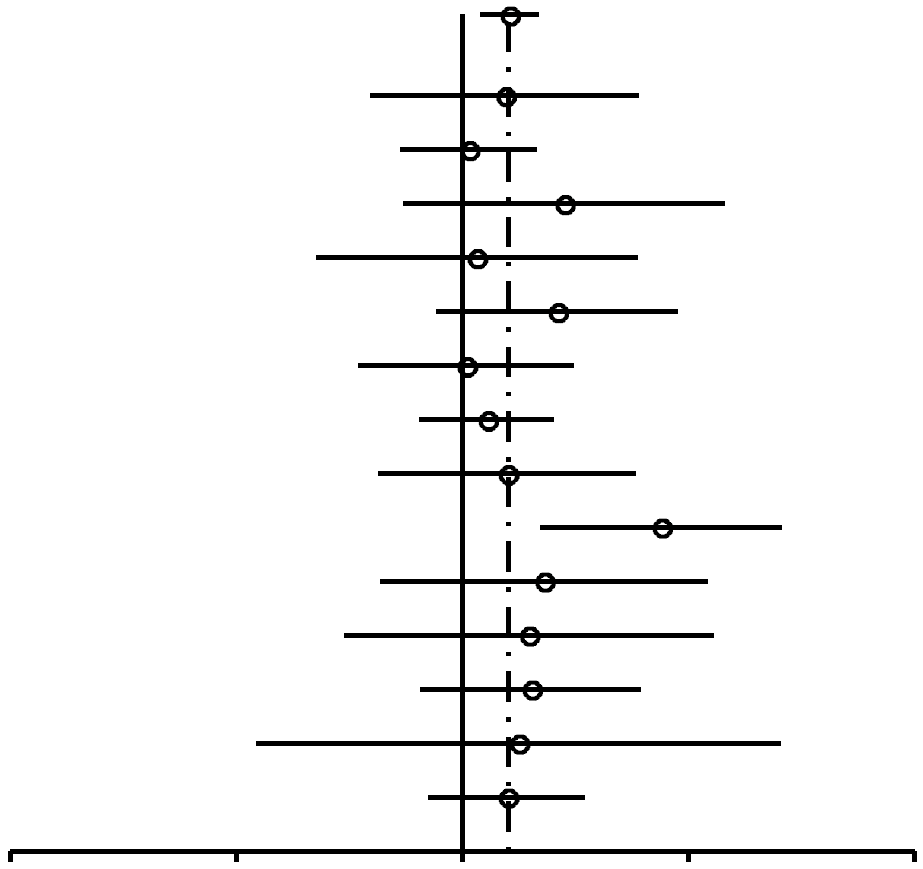 |
||
| Yuan,741988 | 68/71 | 122/145 | 1,14 (0,76-1,72) | 0,61 | |
| Wingo,721993* | 631/611 | 249/246 | 1,02 (0,83-1,26) | 0,89 | |
| Wingo,721993† | 137/158 | 33/52 | 1,37 (0,84-2,24) | 0,26 | |
| White,731994 | 149/193 | 34/46 | 1,04 (0,64-1,71) | 0,96 | |
| Weinstein,711991 | 101/92 | 124/151 | 1,34 (0,92-1,93) | 0,15 | |
| Tavani,301999 | 95/98 | 273/285 | 1,01 (0,73-1,4) | 0,99 | |
| Rosenberg,751996* | 219/335 | 464/765 | 1,08 (0,88-1,32) | 0,51 | |
| Rosenberg,751996† | 57/149 | 83/249 | 1,15 (0,77-1,7) | 0,56 | |
| Palmer,621995 | 76/156 | 79/298 | 1,84 (1,27-2,66) | 0,0016 | |
| Olsson,611989 | 60/179 | 29/111 | 1,28 (0,78-2,12) | 0,40 | |
| Ewertz,471992 | 68/77 | 31/43 | 1,22 (0,7-2,16) | 0,58 | |
| Clavel,461991 | 148/142 | 115/136 | 1,23 (0,88-1,73) | 0,26 | |
| Chie,441998 | 10/21 | 73/182 | 1,19 (0,53-2,64) | 0,83 | |
| Brinton,431995 | 240/246 | 274/322 | 1,15 (0,9-1,46) | 0,29 | |
| 0,250,51,02,04,0 | |||||
FIGURA
3. Resumen de estimaciones de riesgo de cáncer de mama en
mujeres uníparas/ multíparas premenopáusicas y en
mujeres de menos de 50 años asociado al uso de anticonceptivos
orales (AO) |
|||||
El análisis agrupado de Oxford concluyó también que las mujeres que usaron AO no presentaban un aumento del riesgo 10 años después del último uso (es decir, determinó que el riesgo más alto se presentaba en las usuarias de AO actuales o recientes). El estudio llegó también a la conclusión de que, en las mujeres que habían usado AO, el cáncer era menos avanzado que en las mujeres que nunca habían usado AO. Nosotros advertimos dos distinciones con relación a estas conclusiones. En primer lugar, estos resultados no pueden compararse directamente con los nuestros debido a los diferentes parámetros de nuestros análisis. Nosotros nos centramos en el riesgo premenopáusico asociado al uso temprano de AO en estudios de casos y controles en los que los casos desarrollaron cáncer de mama, sobre todo después de 1980; la omisión de 4 (sobre 39) estudios que habían obtenido parte de sus datos antes de 1980 no alteró nuestros resultados (no consignamos estos datos). Las conclusiones del análisis de Oxford en relación a los puntos de referencia se basaron en el uso de AO tanto en mujeres premenopáusicas como posmenopáusicas; dos tercios de las pacientes afectadas de cáncer de mama en el análisis de Oxford tenían más de 45 años84. Además, este análisis incluyó varios estudios de casos y controles cuya base de datos contenía principalmente mujeres que desarrollaron cáncer de mama antes de 1980.19-25,65
|
Casos/Controles |
|||||
| Referencia | Usuarias de AO | No usuarias de AO | RP (95% IC) | Valor P | |
| Todas | 1,44 (1,28-1,62) | 8,1× 10–10 |
 |
||
| Yuan,74 1988 | 5/2 | 122/145 | 2,97 (0,57-15,59) | 0,34 | |
| Wingo,72 1993* | 318/247 | 249/246 | 1,27 (1-1,62) | 0,059 | |
| Wingo,72 1993† | 180/225 | 33/52 | 1,26 (0,78-2,03) | 0,41 | |
| White,73 1994 | 363/450 | 34/46 | 1,09 (0,69-1,74) | 0,80 | |
| Weinstein,71 1991 | 69/52 | 124/151 | 1,62 (1,05-2,49) | 0,038 | |
| Tavani,30 1999 | 59/48 | 273/285 | 1,28 (0,85-1,94) | 0,28 | |
| Rosenberg,75 1996* | 170/125 | 464/765 | 2,24 (1,73-2,9) | 1,0 × 10–9 | |
| Rosenberg,75 1996† | 75/116 | 83/249 | 1,94 (1,32-2,84) | 0,0009 | |
| Rookus,65 1994 | 267/279 | 34/40 | 1,13 (0,69-1,83) | 0,72 | |
| Primic-Zakelj,64 1995 | 33/37 | 288/300 | 0,93 (0,57-1,53) | 0,87 | |
| Paul,63 1990 | 137/535 | 24/91 | 0,97 (0,6-1,58) | 0,99 | |
| Palmer,62 1995 | 32/48 | 79/298 | 2,51 (1,51-4,19) | 0,00054 | |
| Olsson,61 1989 | 63/117 | 29/111 | 2,06 (1,24-3,44) | 0,0075 | |
| Moorman,58 2001 | 221/173 | 129/120 | 1,19 (0,86-1,63) | 0,33 | |
| Meirik,57 1986 | 143/149 | 81/123 | 1,46 (1,01-2,09) | 0,052 | |
| McPherson,56 1987 | 90/51 | 226/263 | 2,05 (1,4-3,02) | 0,00033 | |
| McCredie,55 1998 | 239/185 | 102/87 | 1,1 (0,78-1,56) | 0,64 | |
| Lee,51 1992 | 4/4 | 87/166 | 1,91 (0,47-7,82) | 0,59 | |
| Gomes,48 1995 | 5/8 | 64/169 | 1,65 (0,52-5,23) | 0,59 | |
| Ewertz,47 1992 | 86/72 | 31/43 | 1,66 (0,95-2,9) | 0,10 | |
| Clavel,46 1991 | 37/33 | 115/136 | 1,33 (0,78-2,26) | 0,36 | |
| UK National,45 1989 | 348/357 | 45/54 | 1,17 (0,77-1,78) | 0,53 | |
| Brinton,43 1995 | 725/602 | 274/322 | 1,42 (1,17-1,72) | 0,00053 | |
|
Casos/Controles |
0,250,51,02,04,0 | ||||
| Referencia | Usuarias de AO | No usuarias de AO | RP (95% IC) | Valor P | |
| Todas | 1,52 (1,26-1,82) | 1,0 × 10–5 |
 |
||
| Rosenberg,75 1996* | 34/39 | 464/765 | 1,44 (0,9-2,31) | 0,17 | |
| Rosenberg,75 1996† | 23/30 | 83/249 | 2,3 (1,27-4,18) | 0,0089 | |
| Paul,63 1990 | 31/143 | 24/91 | 0,82 (0,45-1,49) | 0,62 | |
| Palmer,62 1995 | 5/14 | 79/298 | 1,35 (0,47-3,85) | 0,79 | |
| Meirik,57 1986 | 51/48 | 81/123 | 1,61 (1-2,62) | 0,069 | |
| McPherson,56 1987 | 31/12 | 226/263 | 3,01 (1,51-5,99) | 0,002 | |
| Ewertz,47 1992 | 31/37 | 31/43 | 1,16 (0,6-2,26) | 0,78 | |
| Clavel,46 1991 | 9/10 | 115/136 | 1,06 (0,42-2,71) | 0,91 | |
| UK National,45 1989 | 129/103 | 45/54 | 1,5 (0,94-2,41) | 0,12 | |
| Brinton,43 1995 | 296/224 | 274/322 | 1,55 (1,23-1,97) | 0,00033 | |
| 0,250,51,02,04,0 | |||||
FIGURA
4. Resumen de estimaciones de riesgo de cáncer de mama en
mujeres uníparas/ multíparas premenopáusicas y en
mujeres de menos de 50 años asociado al uso de anticonceptivos
orales (AO) |
|||||
En segundo lugar, no pudimos obtener datos sobre el momento de uso de AO (es decir, uso actual, reciente, o período de diez años después del último uso) para el subgrupo específico de mujeres uníparas/ multíparas premenopáusicas que usaron AO antes del PET. Una explicación posible para la conclusión del estudio de Oxford de que los riesgos resultaron más elevados entre las usuarias actuales y recientes reside en la epidemiología de uso. En dicho análisis, las usuarias actuales o recientes probablemente habrían usado AO en décadas más recientes que las mujeres cuyo último uso databa de más de 10 años atrás. Nosotros observamos que las mujeres usaban AO por períodos más prolongados antes del PET en décadas más recientes (como 1980 y 1990), en comparación con décadas anteriores (como 1960 y 1970); por lo tanto, el aumento del riesgo entre las usuarias actuales o recientes detectado en el análisis de Oxford puede reflejar el aumento del riesgo debido al mayor uso de AO antes del PET, tal como nosotros constatamos.
Constatamos que el riesgo en mujeres uníparas/ multíparas que tomaban AO antes del PET (RP, 1,44; 95% IC, 1,28-1,62) era mayor que en mujeres nulíparas que tomaban AO (RP, 1,24; 95% IC, 0,92-1,67). Desconocemos la razón de esta diferencia.
Subdividimos intencionalmente nuestro análisis en diferentes subgrupos (uníparas/ multíparas y nulíparas, por ejemplo). Consideramos que esto fue importante, dado que las mujeres nulíparas podrían presentar factores de riesgo potencial (tales como infertilidad, uso de medicamentos para la infertilidad o síndrome del ovario poliquístico) más frecuentemente que las mujeres uníparas o multíparas.
Nuestro análisis complementa la literatura existente en este campo ya que se centra en estudios realizados a partir de 1980 y que examina el efecto de los AO sobre el cáncer de mama premenopáusico. Nuestros resultados, así como los de estudios previos, son coherentes con la hipótesis según la cual los AO pueden ser carcinogénicos, especialmente cuando se usan antes del PET. El tejido mamario de la mujer nulípara está compuesto por estructuras indiferenciadas, y es recién durante un embarazo a término que la mama alcanza su máximo desarrollo.16 Este desarrollo ocurre en dos fases distintas, una fase temprana de crecimiento y una fase tardía de diferenciación lobular.16 Por ello, las estructuras mamarias indiferenciadas encontradas en el tejido mamario de la mujer nulípara pueden ser más susceptibles a los carcinógenos que las estructuras más diferenciadas halladas en la mama completamente desarrollada. Por ejemplo, en Hiroshima y Nagasaki, Japón, las mujeres nulíparas expuestas a la radiación de la bomba atómica desarrollaron cáncer de mama con mucha mayor frecuencia que las mujeres que habían tenido hijos antes de la exposición.86 Aunque no sea posible establecer directamente el potencial carcinogénico de los AO en el tejido mamario humano in vivo, los estudios en animales sugieren que las hormonas presentes en los AO tienen potencial carcinogénico en roedores, perros y monos.87-92 Además, los AO aceleran la velocidad de división de las células mamarias en mujeres que los toman antes del PET.93 El incremento en la velocidad de división celular está vinculado a un aumento del riesgo de cáncer.94-96 Asimismo, hay evidencia de que los AO actúan a veces mediante un efecto postfertilización (es decir, actúan a veces después de la fertilización, impidiendo la anidación).97 Si este efecto va asociado con cambios hormonales tempranos, como sugieren algunos estudios,98,99 podría tratarse de un mecanismo alternativo para el efecto carcinogénico de los AO, especialmente si se usan antes de PET.
Es importante considerar ciertas preguntas metodológicas para interpretar nuestros resultados en sí mismos o comparados con trabajos previos. En primer lugar, elegimos el método de los efectos aleatorios para este metaanálisis, ya que esperábamos que los estudios difirieran significativamente en muchos factores, incluyendo la duración y los patrones de uso de AO y el período de latencia, y que estos factores afectarían las RP medidas. En segundo lugar, dado que las poblaciones de estudio diferían significativamente en raza y cultura, estos dos factores podrían conducir a diferencias en los sesgos, además de tener efectos directos. Por lo tanto, aunque consideramos que existe una fuerte evidencia de asociación entre uso de AO y cáncer, no pretendemos que cada uno de los estudios incluidos en nuestro análisis deba registrar un efecto. Sin embargo, aunque resulte biológicamente inverosímil que el uso de AO aumente el riesgo y a la vez proteja contra el cáncer de mama en mujeres premenopáusicas, las diferencias en los diseños de los estudios, en la variabilidad, en las características de las pacientes y en los instrumentos de medición, podrían hacer que un estudio individual encontrara una asociación que pareciera contradecir los datos globales disponibles. Por ello, consideramos que el estudio de Traina et al69 (RP, 0,61; P=0,005) es atípico (aunque lo incluimos en nuestro análisis). Al interpretar los resultados de nuestro metaanálisis, es importante comprender los métodos y sus limitaciones. La suposición básica subyacente al modelo de efectos aleatorios es que los estudios analizados son una muestra aleatoria de una amplia población de estudio; la RP promedio en la población de estudio es μ y su error (con distribución normal) es σ. El metaanálisis nos proporciona valores aproximados de µ y de σ, y a partir de éstos determinamos el IC para µ y el valor P de no asociación entre uso de AO y cáncer. Como se señaló más arriba, no esperaríamos que las RP fueran tanto inferiores como superiores a 1, a menos que la sesgo tuviera una función significativa; por lo tanto, el supuesto de que µ se distribuye normalmente constituye un defecto del estudio. Observamos también que el IC calculado en el modelo de efectos aleatorios y el valor p asociado a él deberían interpretarse con cuidado al investigar el vínculo entre uso de AO y cáncer; el modelo de efectos aleatorios estima las propiedades de la RP media de la población, pero algunas de las subpoblaciones evaluadas en los estudios que consideramos en este metaanálisis pueden presentar un riesgo de cáncer mucho mayor que otras.
Deben mencionarse también otras preguntas relativas al diseño de nuestro estudio. Primero, al elegir analizar estudios sobre mujeres premenopáusicas publicados a partir de 1980, nuestro análisis se estructuró de manera tal que incluyó a un gran número mujeres expuestas a los AO antes del PET, a fin de maximizar el período de latencia potencial entre la exposición a los AO y la aparición del cáncer de mama. 100-103 Era improbable que el grupo de mujeres posmenopáusicas incluidas en estudios realizados incluso en 1995 contara con muchas mujeres expuestas a los AO antes del PET. Además, existen antecedentes de la importancia de un período de latencia adecuado entre la exposición al agente carcinogénico y el desarrollo posterior de cáncer de mama. Las sobrevivientes de la bomba atómica experimentaron un aumento dependiente de la dosis en la incidencia de cáncer de mama, que se notó por primera vez 15 años después de la exposición,86 y la relación entre el uso de dietilestilbestrol y el riesgo posterior de cáncer de mama no resultó evidente sino después de 22 años.104 Por lo tanto, es posible que la mayor parte de los estudios previos10,11,13,14 que analizaron datos de estudios realizados antes de 1980 no hayan incluido un período de tiempo adecuado entre la exposición a los AO y el desarrollo posterior del cáncer de mama.
Una segunda cuestión tiene que ver con el cambio relativamente rápido en la edad en que las mujeres comenzaron a utilizar AO en las últimas décadas. Desde fines de la década del 70, las mujeres han usado AO a partir de edades más tempranas y durante períodos de tiempo más prolongados que las mujeres de edad similar en los años 60 y principios de los 70. Por lo tanto, los estudios deben combinar adecuadamente los casos y los controles por edad, de manera que las distribuciones de casos y de controles por categoría de edad sean similares; de lo contrario, cualquier asociación potencial puede resultar incierta. Por ejemplo, si el tamaño muestral de los controles en la categoría de menor edad es mayor que el de los casos en esa misma categoría, el grupo de control contendrá probablemente más mujeres con mayor y más prolongado uso de AO, lo que ocasionaría una subestimación de las RP. Es notable cómo este exceso de controles en el estrato de menor edad comparado con los casos se da en muchos estudios que examinaron uso de AO y riesgo de cáncer de mama. De los 34 estudios incluidos en nuestro metaanálisis, dieciocho estudios30,43,45,46,48,50-52,55-57,60,62,63,69,72,73,75 proporcionaron información sobre la frecuencia de distribución de edad de los casos y los controles. Once (61%)30,43,46,50,60,62,63,69,72,73,75 de estos dieciocho estudios mostraron un efecto de exceso en el grupo de control. Aunque los estudios individuales puedean tratar este factor de potencial ajustando la edad de las participantes en los análisis, o analizando sus datos según pequeños estratos de edad, nosotros no pudimos hacerlo porque no teníamos datos individuales de las participantes de cada estudio. Además, dado que muchos de los estudios individuales no efectuaron análisis estratificados tomando mujeres uníparas/ multíparas o uso de AO con relación al PET, sólo pudimos utilizar estimaciones brutas – y no ajustadas – en nuestro análisis. Sin embargo, al menos en lo que concierne a los análisis no estratificados (que son los únicos para los que pudimos obtener RP ajustadas), la mayor parte de las RP brutas relativas al uso de AO en mujeres antes del PET que calculamos resultaron similares a las RP ajustadas informadas por los autores originales.30,43,45-47,51,55-57,61-63,66,71-73
El sesgo de supervivencia, es decir, la exclusión de mujeres con cáncer de mama más agresivo que podían estar demasiado enfermas o haber fallecido antes de la inclusión en el estudio, es una consideración importante, dado que el uso temprano de AO está asociado a una forma más agresiva de la enfermedad. 105-108 De los 13 estudios43-46,50,52,55,57,59,60,63,65,73 que arrojaron datos adecuados, 9 (69%)45,50,52,55,57,59,63,65,73 presentaban un potencial de sesgo de supervivencia, y 445,50,59,73 de los nueve estudios positivos mostraron que más de 5% de las pacientes habían muerto o estaban demasiado enfermas para ser entrevistadas. Si la mayoría de estas mujeres hubieran sido usuarias de AO, excluirlas de los estudios arrojaría resultados que atenuarían cualquier asociación verdadera. Un efecto atenuado podría también resultar de estudios que excluyeran a las mujeres más jóvenes, como las de 20 y 30 años, quienes serían más proclives a haber usado AO antes del PET.
La definición del uso de AO podría afectar también la estimación del riesgo. En particular, aproximadamente 30% de las mujeres que utilizan AO por primera vez dejan de hacerlo dentro de los seis meses debido a efectos adversos o por otras razones,109,110 y muchas mujeres discontinúan el uso dentro de los 3 meses.111 Estas mujeres son incluidas a menudo en los grupos de usuarias regulares o de usuarias antes del PET, aunque no es claro si esta exposición a corto plazo tiene relación con el incremento en el riesgo de cáncer de mama. Por lo tanto, el hecho de incluirlas en nuestro análisis atenuó probablemente nuestras RP derivadas.
Algunas preguntas relativas a nuestros resultados son discutibles. Primero, dado que limitamos los estudios incluidos a los que tenían un diseño de casos y controles, existe la posibilidad de sesgo de recuerdo, el que elevaría cualquier asociación entre los AO y el cáncer de mama. Sin embargo, la literatura trata explícitamente este tema: 3 estudios independientes entre sí compararon el recuerdo de las pacientes con los registros de prescripción y ningún estudio halló evidencia de un sesgo de recuerdo significativo.45,65,112 La preocupación concerniente al sesgo de recuerdo podría haberse evitado usando estudios prospectivos; sin embargo, no incluimos este tipo de estudios en nuestro análisis, dado que existe escasa información a futuro sobre el momento de uso de AO y el cáncer de mama en mujeres uníparas/ multíparas premenopáusicas. Identificamos 17 estudios prospectivos113-120 (Tabla 2). Dos estudios114,115 examinaron los riesgos de los AO solamente en relación con el cáncer de mama fatal. Uno de ellos estudió exclusivamente mujeres que tenían antecedentes familiares de cáncer de mama. 117 Dos estudios llevados a cabo en Islandia125,127 no tenían información sobre el uso precoz de AO porque el registro nacional del cáncer recopiló información sobre la edad de uso de AO recién a partir de la década del 90. Unicamente 2 estudios prospectivos118,129 examinaron el riesgo de los AO en mujeres que los utilizaban antes del PET, y sólo uno de éstos investigó el riesgo de uso prolongado antes del PET en mujeres premenopáusicas.118 El segundo estudio identificó sólo 4 mujeres premenopáusicas de menos de 45 años que habían utilizado AO durante 5 años o más antes del PET, un número demasiado pequeño para extraer conclusiones significativas. Además, si el uso de AO antes del PET se asociara con cánceres de mama premenopáusicos más agresivos,105-108 las mujeres premenopáusicas con cáncer de mama, al estar ausentes de la población de la que se eligió la cohorte a causa de su muerte temprana, podrían quedar excluidas de estudios prospectivos, o bien de la cohorte original debido al diseño del estudio. Estos factores producirían una subestimación de cualquier efecto verdadero.
|
TABLA 2. Riesgo de Cáncer de Mama Asociado al Uso de Anticonceptivos Orales (Estudios Prospectivos)*
*IC
= intervalo de confianza; RR = riesgo
relativo; †Datos sobre RR tomados del
análisis agrupado de Oxford.83 |
Una limitación de nuestro análisis es que utilizamos RP brutas en lugar de RP ajustadas, debido a la falta de datos disponibles sobre las RP ajustadas según nuliparidad/ uniparidad/ multiparidad o PET. Por lo tanto, no pudimos ajustar factores potenciales de distorsión tales como la edad de la menarca y del primer parto. Sin embargo, si algunos factores de distorsión tuvieran un efecto significativo, podríamos esperar que las RP que calculamos en base a los datos brutos fueran significativamente diferentes de las RP ajustadas según el uso de AO antes del PET, informadas en las publicaciones originales. No parece ser éste el caso. La mayor parte de los estudios30,43,45-47,51,55-57,61-63,66,71-73 informaron RP ajustadas similares a las RP brutas que calculamos en nuestro análisis, lo que sugiere que es improbable que la falta de ajuste de los factores potenciales de distorsión afectara significativamente nuestras conclusiones.
Segundo, no pudimos controlar las dosis hormonales en las preparaciones de AO. El contenido hormonal de los AO ha cambiado a través de los años, y los resultados de estudios en los que las mujeres estaban expuestas predominantemente a altas dosis de anticonceptivos orales estrogénicos y progestínicos pueden no aplicarse a los AO de bajas dosis. Aunque los AO de bajas dosis presentan un menor riesgo trombótico que los AO de altas dosis, los primeros han sido asociados a un mayor riesgo de cáncer de mama en comparación con los regímenes de dosis altas.21,60,65 Por ejemplo, el análisis agrupado de Oxford informó un mayor riesgo de cáncer de mama metastásico en mujeres que tomaban AO trifásicos de bajas dosis frente a AO monofásicos de altas dosis.11 Aunque se desconoce la razón de esta contradicción aparente, podría deberse a las más potentes progestinas utilizadas en los nuevos AO. Aunque las progestinas derivadas de la noretindrona (p. ej., noretindrona, noretinodrel, etinodiol) se usaron exclusivamente en los años 60 y 70, los gonanos (p. ej., desogestrel, norgestrel, norgestimato), que son mucho más potentes que sus precursores,130 se usaron con más frecuencia a partir de fines de la década del 70. Los niveles de progesterona se elevan en la fase lútea y se supone que son responsables del aumento de la velocidad de división de las células mamarias.131 Los anticonceptivos orales hiperestimulan la división celular en la mama de la mujer nulípara pero ejercen su mayor efecto en la fase lútea, cuando las dosis de progestinas contenidas en los AO trifásicos de bajas dosis son más elevadas.93 Las progestinas sintéticas parecen aumentar el riesgo de cáncer de mama. Skegg et al132 advirtieron que las jóvenes en edad reproductiva que utilizaban acetato de medroxiprogesterona inyectable durante 3 años o más tenían un riesgo 190% más alto de padecer cáncer de mama (riesgo relativo, 2,9, 95% IC, 1,2-7,1). Recientemente, la Women’s Health Initiative comprobó en un estudio randomizado un aumento del riesgo de cáncer de mama en mujeres que tomaban una formulación combinada de estrógeno y progestina,8 mientras que en mujeres que recibían estrógenos solos no se observó aumento de riesgo.133 Por lo tanto, es posible que el tipo y la dosis del componente progestínico del AO pueda aumentar el riesgo de cáncer de mama.
En tercer lugar, notamos que no nos era posible obtener datos específicos sobre el tiempo transcurrido desde el último uso por parte de mujeres uníparas/ multíparas premenopáusicas que utilizaban AO antes del PET. Sin embargo, creemos que es razonable suponer que la mayor parte de las pacientes premenopáusicas que tomaron AO antes del PET lo hicieron al menos 10 años atrás, ya que la mujer norteamericana promedio continúa tomando AO durante aproximadamente 5 años.134 En el futuro, la definición de la fecha en que se deja de utilizar AO puede resultar incierta, en la medida en que más mujeres perimenopáusicas utilicen nuevos regímenes de AO de bajas dosis con fines no anticonceptivos. Otra consideración a tener en cuenta es que incluimos todos los estudios hallados en la literatura sin aplicar ningún criterio de evaluación de la calidad. Esto puede explicar algunas de las heterogeneidades que observamos en nuestro análisis y podría sesgar nuestras conclusiones hacia la hipótesis nula. Aunque notamos cierta heterogeneidad en los estudios limitados a las mujeres nulíparas, no pudimos identificar la causa de dicha heterogeneidad. El sesgo de publicación podría afectar también nuestros resultados, aunque el estudio más pequeño incluido en nuestro análisis tenía sólo 200 pacientes, y la construcción de un gráfico en embudo no mostró evidencia de sesgo de publicación (no se presentan datos).
CONCLUSIÓN
En concordancia con la reciente clasificación de la International Agency for Research on Cancer, según la cual los AO son carcinógenos del grupo 1, este metaanálisis sugiere que los AO están asociados con un aumento del riesgo de cáncer de mama premenopáusico, especialmente entre las mujeres que los utilizan antes del PET.
Agradecemos al Dr. Joseph Stanford por su ayuda en la confección del manuscrito y a Chandra Marriott, MPH y a Claudia Leiras, MS, por su colaboración en la obtención y revisión de los datos.
REFERENCIAS
1. Jemal A, Murray T, Ward E, et al. Cancer statistics, 2005 [corrección publicada aparece en CA Cancer J Clin. 2005;55:259]. CA Cancer J Clin. 2005;55:10-30.
2. Breast cancer facts and figures 2003-2004. Atlanta (GA): American Cancer
Society; c2003. Disponible
sur
http://www.cancer.org/etc..
Consultado el 5 de septiembre de 2006. [URL actualizada en abril de 2011.]
3. Ries LAG, Eisner MP, Kosary CL, et al, eds. SEER Cancer Statistics Review, 1973-1999. Bethesda (MD): National Cancer Institute; 2002. Disponible sur : http://seer.cancer.gov/csr/1973_1999/. Consultado el 5 de septiembre de 2006.
4. Newcomb PA, Storer BE, Longnecker MP, et al. Lactation and a reduced risk of premenopausal breast cancer. N Engl J Med. 1994;330:81-87.
5. McTiernan A, Thomas DB. Evidence for a protective effect of lactation on risk of breast cancer in young women: results from a case-control study. Am J Epidemiol. 1986;124:353-358.
6. Lowe CR, MacMahon B. Breast cancer and reproductive history of women in South Wales. Lancet. 1970;1:153-156.
7. Mirra AP, Cole P, MacMahon B. Breast cancer in an area of high parity: Sao Paulo, Brazil. Cancer Res. 1971;31:77-83.
8. Chlebowski RT, Hendrix SL, Langer RD, et al, WHI Investigators. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women's Health Initiative Randomized Trial. JAMA. 2003;289:3243-3253.
9. Centre International de Recherche sur le Cancer de l'OMS (CIRC). Le programme des monographies du CIRC classe les contraceptifs oestroprogestatifs et l'hormonothérapie ménopausique comme cancérogènes [communiqué de presse 167]. 29 de julio de 2005. Consultado el 1 de septiembre de 2006. Disponible aquí [URL actualizada en abril de 2011.]
10. Romieu I, Berlin JA, Colditz G. Oral contraceptives and breast cancer: review and meta-analysis. Cancer. 1990;66:2253-2263.
11. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: further results. Contraception. 1996;54(suppl): 1S-106S.
12. Thomas DB. Oral contraceptives and breast cancer: review of the epidemiologic literature. Contraception. 1991;43:597-642.
13. Hawley W, Nuovo J, DeNeef CP, Carter P. Do oral contraceptive agents affect the risk of breast cancer? A meta-analysis of the case-control reports. J Am Board Fam Pract. 1993;6:123-135.
14. Delgado-Rodriguez M, Sillero-Arenas M, Rodriguez-Contreras R, Lopez Gigosos R, Galvez Vargas R. Oral contraceptives and breast cancer: a meta-analysis. Rev Epidemiol Sante Publique. 1991;39:165-181.
15. Rushton L, Jones DR. Oral contraceptive use and breast cancer risk: a meta-analysis of variations with age at diagnosis, parity and total duration of oral contraceptive use. Br J Obstet Gynaecol. 1992;99:239-246.
16. Russo J, Hu YF, Silva ID, Russo IH. Cancer risk related to mammary gland structure and development. Microsc Res Tech. 2001;52:204-223.
17. Kelsey JL. A review of the epidemiology of human breast cancer. Epidemiol Rev. 1979;1:74-109.
18. Helmrich SP, Shapiro S, Rosenberg L, et al. Risk factors for breast cancer. Am J Epidemiol. 1983;117:35-45.
19. Ross RK, Paganini-Hill A, Gerkins VR, et al. A case-control study of menopausal estrogen therapy and breast cancer. JAMA. 1980;243:1635-1639.
20. Stanford JL, Brinton LA, Hoover RN. Oral contraceptives and breast cancer: results from an expanded case-control study. Br J Cancer. 1989;60:375-381.
21. Ursin G, Aragaki CC, Paganini-Hill A, Siemiatycki J, Thompson WD, Haile RW. Oral contraceptives and premenopausal bilateral breast cancer: a case-control study. Epidemiology. 1992;3:414-419.
22. Pike MC, Henderson BE, Krailo MD, Duke A, Roy S. Breast cancer in young women and use of oral contraceptives: possible modifying effect of formulation and age at use. Lancet. 1983;2:926-930.
23. Morabia A, Szklo M, Stewart W, Schuman L, Thomas DB. Consistent lack of association between breast cancer and oral contraceptives using either hospital or neighborhood controls. Prev Med. 1993;22:178-186.
24. Vessey M, Baron J, Doll R, McPherson K, Yeates D. Oral contraceptives and breast cancer: final report of an epidemiological study. Br J Cancer. 1983;47:455-462.
25. Schildkraut JM, Hulka BS, Wilkinson WE. Oral contraceptives and breast cancer: a case-control study with hospital and community controls. Obstet Gynecol. 1990;76:395 402.
26. Yang CP, Daling JR, Band PR, Gallagher RP, White E, Weiss NS. Noncontraceptive hormone use and risk of breast cancer. Cancer Causes Control. 1992;3:475-479.
27. Rossing MA, Stanford JL, Weiss NS, Habel LA. Oral contraceptive use and risk of breast cancer in middle-aged women. Am J Epidemiol. 1996;144:161-164.
28. Tavani A, Negri E, Franceschi S, Parazzini F, La Vecchia C. Oral contraceptives and breast cancer in northern Italy: final report from a case-control study. Br J Cancer. 1993;68:568-571.
29. La Vecchia C, Negri E, Franceschi S, et al. Oral contraceptives and breast cancer: a cooperative Italian study. Int J Cancer. 1995;60:163-167.
30. Tavani A, Gallus S, La Vecchia C, et al. Risk factors for breast cancer in women under 40 years. Eur J Cancer. 1999;35:1361-1367.
31. Sanderson M, Shu XO, Jin F, et al. Abortion history and breast cancer risk: results from the Shanghai Breast Cancer Study. Int J Cancer. 2001;92:899-905.
32. Hislop TG, Coldman AJ, Elwood JM, Brauer G, Kan L. Childhood and recent eating patterns and risk of breast cancer. Cancer Detect Prev. 1986;9:47-58.
33. Rohan TE, McMichael AJ. Oral contraceptive agents and breast cancer: a population-based case-control study. Med J Aust. 1988;149:520-526.
34. Segala C, Gerber M, Richardson S. The pattern of risk factors for breast cancer in a southern France population: interest for a stratified analysis by age at diagnosis. Br J Cancer. 1991;64:919-925.
35. Siskind V, Schofield F, Rice D, Bain C. Breast cancer and breastfeeding: results from an Australian case-control study. Am J Epidemiol. 1989;130:229-236.
36. Bustan MN, Coker AL, Addy CL, Macera CA, Greene F, Sampoerno D. Oral contraceptive use and breast cancer in Indonesia. Contraception. 1993;47:241-249.
37. Ngelangel C, Lacaya LB, Cordero C, Laudico AV. Risk factors for breast cancer among Filipino women. Philipp J Intern Med. 1994;32:231-236.
38. Ravnihar B, Primic Zakelj M, Kosmelj K, Stare J. A case-control study of breast cancer in relation to oral contraceptive use in Slovenia. Neoplasma. 1988;35:109-121.
39. Talamini R, La Vecchia C, Franceschi S, et al. Reproductive and hormonal factors and breast cancer in a Northern Italian population. Int J Epidemiol. 1985;14:70-74.
40. Wang QS, Ross RK, Yu MC, Ning JP, Henderson BE, Kimm HT. A case-control study of breast cancer in Tianjin, China. Cancer Epidemiol Biomarkers Prev. 1992;1:435-439.
41. Ellery C, MacLennan R, Berry G, Shearman RP. A case-control study of breast cancer in relation to the use of steroid contraceptive agents. Med J Aust. 1986;144:173-176.
42. Ursin G, Ross RK, Sullivan-Halley J, Hanisch R, Henderson B, Bernstein L. Use of oral contraceptives and risk of breast cancer in young women. Breast Cancer Res Treat. 1998;50:175-184.
43. Brinton LA, Daling JR, Liff JM, et al. Oral contraceptives and breast cancer risk among younger women. J Natl Cancer Inst. 1995;87:827-835.
44. Chie WC, Li CY, Huang CS, Chang KJ, Yen ML, Lin RS. Oral contraceptives and breast cancer risk in Taiwan, a country of low incidence of breast cancer and low use of oral contraceptives. Int J Cancer. 1998;77:219-223.
45. UK National Case-Control Study Group. Oral contraceptive use and breast cancer risk in young women. Lancet. 1989;1:973-982.
46. Clavel F, Andrieu N, Gairard B, et al. Oral contraceptives and breast cancer: a French case-control study. Int J Epidemiol. 1991;20:32-38.
47. Ewertz M. Oral contraceptives and breast cancer risk in Denmark. Eur J Cancer. 1992;28A:1176-1181.
48. Gomes AL, Guimaraes MD, Gomes CC, Chaves IG, Gobbi H, Camargos AF. A case-control study of risk factors for breast cancer in Brazil, 1978-1987. Int J Epidemiol. 1995;24:292-299.
49. Le MG, Bachelot A, Doyen F, Kramar A. Étude de la relation entre contraception orale et cancer du sein ou du col utérin : résultats préliminaires d'une enquête française. Contracept Fertil Sex (Paris). 1985 ; 13 : 553-558.
50. Lee NC, Rosero-Bixby L, Oberle MW, Grimaldo C, Whatley AS, Rovira EZ. A case-control study of breast cancer and hormonal contraception in Costa Rica. J Natl Cancer Inst. 1987;79:1247-1254.
51. Lee HP, Gourley L, Duffy SW, Esteve J, Lee J, Day NE. Risk factors for breast cancer by age and menopausal status: a case-control study in Singapore. Cancer Causes Control. 1992;3:313-322.
52. Marchbanks PA, McDonald JA, Wilson HG, et al. Oral contraceptives and the risk of breast cancer. N Engl J Med. 2002;346:2025-2032.
53. Marcus PM, Baird DD, Millikan RC, Moorman PG, Qaqish B, Newman B. Adolescent reproductive events and subsequent breast cancer risk. Am J Public Health. 1999;89:1244-1247.
54. Marubini E, Decarli A, Costa A, et al. The relationship of dietary intake and serum levels of retinol and beta-carotene with breast cancer: results of a case-control study. Cancer. 1988;61:173-180.
55. McCredie MR, Dite GS, Giles GG, Hopper JL. Breast cancer in Australian women under the age of 40. Cancer Causes Control. 1998;9:189-198.
56. McPherson K, Vessey MP, Neil A, Doll R, Jones L, Roberts M. Early oral contraceptive use and breast cancer: results of another case-control study. Br J Cancer. 1987;56:653-660.
57. Meirik O, Lund E, Adami HO, Bergstrom R, Christoffersen T, Bergsjo P. Oral contraceptive use and breast cancer in young women: a joint national case-control study in Sweden and Norway. Lancet. 1986;2:650-654.
58. Moorman PG, Millikan RC, Newman B. Oral contraceptives and breast cancer among African-American women and white women. J Natl Med Assoc. 2001;93:329-334.
59. Newcomb PA, Longnecker MP, Storer BE, et al. Recent oral contraceptive use and risk of breast cancer (United States). Cancer Causes Control. 1996; 7:525-532.
60. WHO Collaborative Study of Neoplasia and Steroid Contraceptives. Breast cancer and combined oral contraceptives: results from a multinational study. Br J Cancer. 1990;61:110-119.
61. Olsson H, Moller TR, Ranstam J. Early oral contraceptive use and breast cancer among premenopausal women: final report from a study in southern Sweden. J Natl Cancer Inst. 1989;81:1000-1004.
62. Palmer JR, Rosenberg L, Rao RS, et al. Oral contraceptive use and breast cancer risk among African-American women. Cancer Causes Control. 1995;6:321-331.
63. Paul C, Skegg DC, Spears GF. Oral contraceptives and risk of breast cancer. Int J Cancer. 1990;46:366-373.
64. Primic-Zakelj M, Evs.tifeeva T, Ravnihar B, Boyle P. Breast-cancer risk and oral contraceptive use in Slovenian women aged 25 to 54. Int J Cancer. 1995;62:414-420.
65. Rookus MA, van Leeuwen FE, Netherlands Oral Contraceptives and Breast Cancer Study Group. Oral contraceptives and risk of breast cancer in women aged 20-54 years. Lancet. 1994;344:844-851.
66. Rosenberg L, Palmer JR, Clarke EA, Shapiro S. A case-control study of the risk of breast cancer in relation to oral contraceptive use. Am J Epidemiol. 1992;136:1437-1444.
67. Shapiro S, Rosenberg L, Hoffman M, et al. Risk of breast cancer in relation to the use of injectable progestogen contraceptives and combined estrogen/progestogen contraceptives [corrección publicada aparece en Am J Epidemiol. 2000;151:1134]. Am J Epidemiol. 2000;151:396-403.
68. Tessaro S, Beria JU, Tomasi E, Barros AJ. Oral contraceptives and breast cancer: a case-control study [en Portugais]. Rev Saude Publica. 2001 ; 35 : 32-38.
69. Traina A, Cusimano R, Liquori M, et al. Oral contraceptive use and breast cancer risk in areas with different incidence: a case-control study among young women. Ann N Y Acad Sci. 1996;784:564-569.
70. Ursin G, Wu AH, Hoover RN, et al. Breast cancer and oral contraceptive use in Asian-American women. Am J Epidemiol. 1999;150:561-567.
71. Weinstein AL, Mahoney MC, Nasca PC, Leske MC, Varma AO. Breast cancer risk and oral contraceptive use: results from a large case-control study. Epidemiology. 1991;2:353-358.
72. Wingo PA, Lee NC, Ory HW, Beral V, Peterson HB, Rhodes P. Agespecific differences in the relationship between oral contraceptive use and breast cancer. Cancer. 1993;71(suppl):1506-1517.
73. White E, Malone KE, Weiss NS, Daling JR. Breast cancer among young U.S. women in relation to oral contraceptive use. J Natl Cancer Inst. 1994; 86:505-514.
74. Yuan JM, Yu MC, Ross RK, Gao YT, Henderson BE. Risk factors for breast cancer in Chinese women in Shanghai. Cancer Res. 1988;48:1949-1953.
75. Rosenberg L, Palmer JR, Rao RS, et al. Case-control study of oral contraceptive use and risk of breast cancer. Am J Epidemiol. 1996;143:25-37.
76. The Centers for Disease Control Cancer and Steroid Hormone Study. Long-term oral contraceptive use and the risk of breast cancer. JAMA. 1983;249:1591-1595.
77. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development. Oral-contraceptive use and the risk of breast cancer. N Engl J Med. 1986;315:405-411.
78. Stadel BV, Lai SH, Schlesselman JJ, Murray P. Oral contraceptives and premenopausal breast cancer in nulliparous women. Contraception. 1988;38: 287-299.
79. Mayberry RM. Age-specific patterns of association between breast cancer and risk factors in black women, ages 20 to 39 and 40 to 54. Ann Epidemiol. 1994;4:205-213.
80. Miller DR, Rosenberg L, Kaufman DW, Stolley P, Warshauer ME, Shapiro S. Breast cancer before age 45 and oral contraceptive use: new findings. Am J Epidemiol. 1989;129:269-280.
81. Lund E, Meirik O, Adami HO, Bergstrom R, Christoffersen T, Bergsjo P. Oral contraceptive use and premenopausal breast cancer in Sweden and Norway: possible effects of different pattern of use. Int J Epidemiol. 1989;18:527-532.
82. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177-188.
83. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Lancet. 1996;347:1713-1727.
84. Althuis MD, Brogan DR, Coates RJ, et al. Hormonal content and potency of oral contraceptives and breast cancer risk among young women. Br J Cancer. 2003;88:50-57.
85. Nomura AM, Kolonel LN, Hirohata T, Lee J. The association of replacement estrogens with breast cancer. Int J Cancer. 1986;37:49-53.
86. McGregor H, Land CE, Choi K, et al. Breast cancer incidence among atomic bomb survivors, Hiroshima and Nagasaki, 1950-69. J Natl Cancer Inst. 1977;59:799-811.
87. Kirschstein RL, Rabson AS, Rusten GW. Infiltrating duct carcinoma of the mammary gland of a rhesus monkey after administration of an oral contraceptive: a preliminary report. J Natl Cancer Inst. 1972;48:551-556.
88. Geil RG, Lamar JK. FDA studies of estrogen, progestogens, and estrogen/progestogen combinations in the dog and monkey. J Toxicol Environ Health. 1977;3:179-193.
89. Shubik P. Oral contraceptives and breast cancer: laboratory evidence. IARC Sci Publ. 1985;(65):33-35.
90. Lanari C, Molinolo AA, Pasqualini CD. Induction of mammary adenocarcinomas by medroxyprogesterone acetate in BALB/c female mice. Cancer Lett. 1986;33:215-223.
91. Welsch CW, Adams C, Lambrecht LK, Hassett CC, Brooks CL. 17betaoestradiol and Enovid mammary tumorigenesis in C3H/HeJ female mice: counteraction by concurrent 2-bromo-alpha-ergocryptine. Br J Cancer. 1977;35:322-328.
92. Kahn RH, Baker BL. Effect of long-term treatment with norethynodrel on A-J and C3H-HeJ mice. Endocrinology. 1969;84:661-668.
93. Anderson TJ, Battersby S, King RJ, McPherson K, Going JJ. Oral contraceptive use influences resting breast proliferation. Hum Pathol. 1989;20:1139-1144.
94. Preston-Martin S, Pike MC, Ross RK, Jones PA, Henderson BE. Increased cell division as a cause of human cancer. Cancer Res. 1990;50:7415-7421.
95. Ames BN, Gold LS. Too many rodent carcinogens: mitogenesis increases mutagenesis. Science.1990;249:970-971.
96. Cohen SM, Ellwein LB. Cell proliferation in carcinogenesis. Science. 1990;249:1007-1011.
97. Larimore WL, Stanford JB. Postfertilization effects of oral contraceptives and their relationship to informed consent. Arch Fam Med. 2000;9:126-133.
98. Norman RJ, McLoughlin JW, Borthwick GM, et al. Inhibin and relaxin concentrations in early singleton, multiple, and failing pregnancy: relationship to gonadotropin and steroid profiles. Fertil Steril. 1993;59:130-137.
99. Stewart DR, Overstreet JW, Nakajima ST, Lasley BL. Enhanced ovarian steroid secretion before implantation in early human pregnancy. J Clin Endocrinol Metab. 1993;76:1470-1476.
100. Another look at the pill and breast cancer. Lancet. 1985;2:985-987.
101. Hulka BS. Oral contraceptives: the good news. JAMA. 1983;249:1624-1625.
102. Olsson H, Borg A, Ferno M, Moller TR, Ranstam J. Early oral contraceptive use and premenopausal breast cancer: a review of studies performed in southern Sweden. Cancer Detect Prev. 1991;15:265-271.
103. Malone KE, Daling JR, Weiss NS. Oral contraceptives in relation to breast cancer. Epidemiol Rev. 1993;15:80-97.
104. Colton T, Greenberg ER, Noller K, et al. Breast cancer in mothers prescribed diethylstilbestrol in pregnancy: further follow-up. JAMA. 1993;269:2096-2100.
105. Olsson H, Ranstam J, Baldetorp B, et al. Proliferation and DNA ploidy in malignant breast tumors in relation to early oral contraceptive use and early abortions. Cancer. 1991;67:1285-1290.
106. Olsson H, Borg A, Ferno M, Ranstam J, Sigurdsson H. Her-2/neu and INT2 proto-oncogene amplification in malignant breast tumors in relation to reproductive factors and exposure to exogenous hormones. J Natl Cancer Inst. 1991;83:1483-1487.
107. Ranstam J, Olsson H, Garne JP, Aspegren K, Janzon L. Survival in breast cancer and age at start of oral contraceptive usage. Anticancer Res. 1991; 11:2043-2046.
108. Gammon MD, Hibshoosh H, Terry MB, et al. Oral contraceptive use and other risk factors in relation to HER-2/neu overexpression in breast cancer among young women. Cancer Epidemiol Biomarkers Prev. 1999;8:413-419.
109. Rosenberg MJ, Waugh MS. Oral contraceptive discontinuation: a prospective evaluation of frequency and reasons. Am J Obstet Gynecol. 1998;179: 577-582.
110. Potter LS. Oral contraceptive compliance and its role in the effectiveness of the method. In: Cramer JA, Spilker B, eds. Patient Compliance In Medical Practice and Clinical Trials. New York: Raven Press; 1991: 195-207.
111. Balassone ML. Risk of contraceptive discontinuation among adolescents. J Adolesc Health Care. 1989;10:527-533.
112. Nischan P, Ebeling K, Thomas DB, Hirsch U. Comparison of recalled and validated oral contraceptive histories. Am J Epidemiol. 1993;138:697-703.
113. Alexander FE, Roberts MM, Huggins A. Risk factors for breast cancer with applications to selection for the prevalence screen. J Epidemiol Community Health. 1987;41:101-106.
114. Beral V, Hermon C, Kay C, Hannaford P, Darby S, Reeves G. Mortality associated with oral contraceptive use: 25 year follow up of cohort of 46 000 women from Royal College of General Practitioners' oral contraception study. BMJ. 1999;318:96-100.
115. Calle EE, Martin LM, Thun MJ, Miracle HL, Heath CW Jr. Family history, age, and risk of fatal breast cancer. Am J Epidemiol. 1993;138:675-681.
116. Dumeaux V, Alsaker E, Lund E. Breast cancer and specific types of oral contraceptives: a large Norwegian cohort study. Int J Cancer. 2003;105:844-850.
117. Grabrick DM, Hartmann LC, Cerhan JR, et al. Risk of breast cancer with oral contraceptive use in women with a family history of breast cancer. JAMA. 2000;284:1791-1798.
118. Hankinson SE, Colditz GA, Manson JE, et al. A prospective study of oral contraceptive use and risk of breast cancer (Nurses' Health Study, United States). Cancer Causes Control. 1997;8:65-72.
119. Hiatt RA, Bawol R, Friedman GD, Hoover R. Exogenous estrogen and breast cancer after bilateral oophorectomy. Cancer. 1984;54:139-144.
120. Kay CR, Hannaford PC. Breast cancer and the pill: a further report from the Royal College of General Practitioners' oral contraception study. Br J Cancer. 1988;58:675-680.
121. Kumle M, Weiderpass E, Braaten T, Persson I, Adami HO, Lund E. Use of oral contraceptives and breast cancer risk: the Norwegian-Swedish Women's Lifestyle and Health Cohort Study. Cancer Epidemiol Biomarkers Prev. 2002;11:1375-1381.
122. Miller AB, Baines CJ, To T, Wall C. Canadian National Breast Screening Study: 1. Breast cancer detection and death rates among women aged 40 to 49 years [corrección publicada aparece en CMAJ. 1993;148:718]. CMAJ. 1992;147: 1459-1476.
123. Mills PK, Beeson WL, Phillips RL, Fraser GE. Prospective study of exogenous hormone use and breast cancer in Seventh-day Adventists. Cancer. 1989;64:591-597.
124. Schuurman AG, van den Brandt PA, Goldbohm RA. Exogenous hormone use and the risk of postmenopausal breast cancer: results from The Netherlands Cohort Study. Cancer Causes Control. 1995;6:416-424.
125. Tomasson H, Tomasson K. Oral contraceptives and risk of breast cancer: a historical prospective case-control study. Acta Obstet Gynecol Scand. 1996;75:157-161.
126. Trapido EJ. A prospective cohort study of oral contraceptives and breast cancer. J Natl Cancer Inst. 1981;67:1011-1015.
127. Tryggvadottir L, Tulinius H, Gudmundsdottir GB. Oral contraceptive use at a young age and the risk of breast cancer: an Icelandic, population-based cohort study of the effect of birth year. Br J Cancer. 1997;75:139-143.
128. Van Hoften C, Burger H, Peeters PH, Grobbee DE, Van Noord PA, Leufkens HG. Long-term oral contraceptive use increases breast cancer risk in women over 55 years of age: the DOM cohort. Int J Cancer. 2000;87:591-594.
129. Vessey MP, McPherson K, Villard-Mackintosh L, Yeates D. Oral contraceptives and breast cancer: latest findings in a large cohort study. Br J Cancer. 1989;59:613-617.
130. Dickey RP, Stone SC. Progestational potency of oral contraceptives. Obstet Gynecol. 1976;47:106-112.
131. Staffa JA, Newschaffer CJ, Jones JK, Miller V. Progestins and breast cancer: an epidemiologic review. Fertil Steril. 1992;57:473-491.
132. Skegg DC, Noonan EA, Paul C, Spears GF, Meirik O, Thomas DB. Depot medroxyprogesterone acetate and breast cancer: a pooled analysis of the World Health Organization and New Zealand studies. JAMA. 1995;273:799-804.
133. Anderson GL, Limacher M, Assaf AR, et al, Women's Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA. 2004;291:1701-1712.
134. Tyrer L. Introduction of the pill and its impact. Contraception. 1999; 59 (suppl):11S-16S.
Traducción en Español del
artículo publicado originalmente en Mayo Clinic Proceedings de octubre de 2006, vol. 81, n°10, pp 1290-1302.
Esta traducción fue realizado por el T.D.D., 119bis rue de Colombes - 92600 ASNIÈRES SUR SEINE, Francia - correo electrónico